Nomenclature des composés inorganiques
1. Composés ioniques : cations
Les cations formés à partir d'un métal sont en général monoatomiques. On les nomme : ion + « nom du métal »
$\text{N}{{\text{a}}^{\text{+}}}$ ion sodium $\text{Z}{{\text{n}}^{\text{2+}}}$ ion zinc $\text{A}{{\text{l}}^{\text{3+}}}$ ion aluminium
Si le métal peut former plusieurs cations, on note la charge de l'ion en chiffre romain :
$\text{F}{{\text{e}}^{\text{2+}}}$ ion fer II ou ion ferreux $\text{C}{{\text{u}}^{\text{+}}}$ ion cuivreux
$\text{F}{{\text{e}}^{\text{3+}}}$ ion fer III ou ion ferrique $\text{C}{{\text{u}}^{\text{2+}}}$ ion cuivrique
Il existe des cations polyatomiques : $\text{NH}_{\text{4}}^{\text{+}}$ ion ammonium, ${{\text{H}}_{\text{3}}}{{\text{O}}^{\text{+}}}$ ion hydronium
2. Composés ioniques : anions
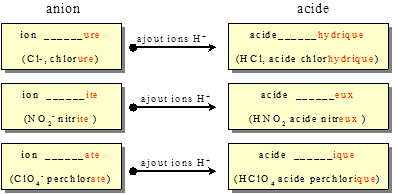
S'ils sont monoatomiques, ils sont formés à partir d'un non-métal. On ajoute le suffixe « ure » au nom de l'élément.
$\text{C}{{\text{l}}^{\text{-}}}$ ion chlorure ${{\text{S}}^{\text{2-}}}$ ion sulfure ${{\text{N}}^{\text{3-}}}$ ion nitrure (azote = nitrogen en anglais)
Exception : ${{\text{O}}^{\text{2-}}}$ ion oxyde
S'ils sont polyatomiques et contiennent de l'oxygène, ce sont des polyanions :
avec le moins d'oxygène : on ajoute le suffixe « ite » ($\text{NO}_{\text{2}}^{\text{-}}$ ion nitrite)
avec le plus d'oxygène : on ajoute le suffixe « ate » ($\text{NO}_{\text{3}}^{\text{-}}$ ion nitrate)
Exception : $\text{O}{{\text{H}}^{\text{-}}}$ ion hydroxyde
Si un élément forme plus d'un oxyanion on ajoute :
le préfixe « hypo » pour l'ion où le nombre d'oxydation de l'élément est le plus faible (hypo_____ite)
le suffixe « per » pour le nombre d'oxydation le plus grand (per____ate):
$\text{Cl}{{\text{O}}^{\text{-}}}$ ion hypochlorite $\text{ClO}_{\text{2}}^{\text{-}}$ ion chlorite $\text{ClO}_{\text{3}}^{\text{-}}$ ion chlorate $\text{ClO}_{\text{4}}^{\text{-}}$ ion perchlorate
3. Acides correspondant aux anions et oxyanions
Pour les polyacides, on peut former plusieurs anions par perte d'ion ${{H}^{+}}$ :
${{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$ donne | $\text{HSO}_{\text{4}}^{\text{-}}$ ion hydrogéno-sulfate (ancien nom bisulfate) |
${{\text{H}}_{\text{3}}}\text{P}{{\text{O}}_{\text{4}}}$ donne | ${{\text{H}}_{\text{2}}}\text{PO}_{\text{4}}^{\text{-}}$ ion dihydrogéno-phosphate |
$\text{HPO}_{\text{4}}^{\text{2-}}$ ion monohydrogéno-phosphate |
4. Composés ioniques et moléculaires
On construit le nom du composé à partir des ions présents dans l'ordre anion cation. La formule chimique s'écrit en indiquant tout d'abord le cation :
$\text{HCl}$ chlorure d'hydrogène, $\text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}$ carbonate de sodium
$\text{CuCl}$ chlorure cuivreux, $\text{A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}$ oxyde d'aluminium
Pour les composés binaires formés à partir de non-métaux, on peut avoir plusieurs formules que l'on va nommer en ajoutant un préfixe numérique ( mono, di, tri , tétra, penta, hexa...):
$\text{CO}$ monoxyde de carbone, $\text{C}{{\text{O}}_{\text{2}}}$ dioxyde de carbone
$\text{PC}{{\text{l}}_{\text{3}}}$ trichlorure de phosphore, $\text{PC}{{\text{l}}_{\text{5}}}$ pentachlorure de phosphore
On procède de même pour les composés à base de métaux de transition qui possèdent généralement plusieurs nombre d'oxydation :
$\text{Mn}{{\text{O}}_{\text{2}}}$ dioxyde de manganèse, $\text{MnO}$ oxyde de manganèse




