Caractères de la liaison ionique
Alors que la liaison covalente est une liaison dirigée (due à la localisation du/des doublets de liaison), la liaison ionique est une liaison d'interaction électrostatique non directionnelle (chaque ion est soumis au champ de ses voisins ). L'énergie d'interaction entre 2 ions de charges z1 et z2 distants de r comprend un terme de répulsion (premier terme) et un terme d'attraction coulombienne : $${{E}_{\operatorname{int}}}=\frac{a}{{{r}^{n}}}-\frac{{{z}_{1}}{{z}_{2}}}{4\pi {{\varepsilon }_{0}}}\frac{{{e}^{2}}}{r}$$ La courbe dite de MORSE traite le cas du composé ionique MX et montre les contributions. La distance M-X correspond au minimum d'énergie. | 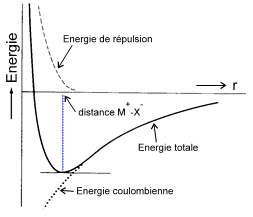 |
L'énergie de répulsion varie très vite si r est petit (car $\text{n}\approx \text{7-8}$ ).
Les composés ioniques sont :
des composés durs, à températures de fusion et d'ébullition élevées ; ils sont conducteurs de l'électricité à l'état fondu.
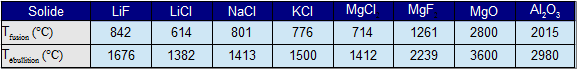
des composés solubles dans les solvants polaires comme ${{\text{H}}_{\text{2}}}\text{O, C}{{\text{H}}_{\text{3}}}\text{CN, N}{{\text{H}}_{\text{3}}}$ liquide (à constante diélectrique élevée; le terme d'attraction de l'énergie est faible devant le terme répulsif), l'énergie de vibration (agitation d'origine thermique) devenant supérieure à l'énergie de liaison.




