Aspects énergétiques d'une réaction chimique
Les réactions chimiques mettent en jeu de l'énergie sous forme
de chaleur Q
de travail mécanique de la pression extérieur W
ou autre W' (électrique/ exemple).
La chaleur (énergie thermique)
Effets physiques de la chaleur
Un apport de chaleur se traduit par un échauffement (élévation de température) ou un changement d'état physique : fusion, vaporisation, sublimation.
Une soustraction de chaleur se traduit par un refroidissement (abaissement de température) ou changement d'état physique : solidification, liquéfaction, condensation.
Expression des quantités de chaleur
Pour une petite transformation $\text{ }\!\!\delta\!\!\text{ Q}$ quantité de chaleur reçue par le système, que ce soit un échauffement ou un refroidissement :
$$\delta Q = C.dT$$
où dT représente l'accroissement de température et C la capacité calorifique en $\text{J}\text{.}{{\text{K}}^{\text{-1}}}$. $\text{ }\!\!\delta\!\!\text{ Q}$ est appelé chaleur élémentaire.
Remarque : parfois C capacité calorifique molaire $\text{J}\text{.}{{\text{K}}^{\text{-1}}}\text{.mo}{{\text{l}}^{\text{-1}}}$ alors $\text{ }\!\!\delta\!\!\text{ Q=nC}\text{.dT}$ .
Si c'est un changement d'état, $\text{ }\!\!\delta\!\!\text{ Q=nL}$ où L représente la chaleur de changement d'état en $\text{J}\text{.mo}{{\text{l}}^{\text{-1}}}$ et n le nombre de moles transformées.
Signe de Q
Q < 0 le système libère de la chaleur ; la réaction est dite exothermique (ex $\text{NaOH}$ dans l'eau).
Q > 0 le système gagne de la chaleur ; la réaction est dite endothermique (ex : $\text{KN}{{\text{O}}_{\text{3}}}$ dans l'eau).
Q = 0 pas d'échange avec l'extérieur ; la réaction est dite athermique (équilibre d'estérification).
Mesure de quantité de chaleur : la calorimétrie
Il faut au préalable l'étalonner (mélange eau chaude /eau froide ou autre réaction, dissolution de chlorure d'ammonium dans l'eau) On met un réactif dans le calorimètre ; on attend l'équilibre thermique ; on note ${{\text{T}}_{\text{1}}}$. On met le deuxième réactif à la température ${{\text{T}}_{\text{2}}}$ ; on attend l'équilibre thermique et on note ${{\text{T}}_{\text{3}}}$. | 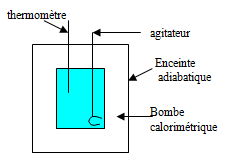 |
Les conditions adiabatiques :
$$\sum{quantit\acute{e}s\text{ }de\text{ }chaleur\text{ }\acute{e}chang\acute{e}es=0}$$ .
On en déduit après calcul la capacité calorifique du calorimètre ou sa masse équivalente en eau.




