Diagramme potentiel-pH du fer
Les diagrammes de POURBAIX (ou diagrammes potentiel-pH) permettent de suivre l'évolution du système redox avec le pH (et la précipitation éventuelle des phases). On cherche les droites sur lesquelles [Ox]=[Red], au-dessus de la droite la forme oxydée prédomine .
On trace ici le diagramme potentiel pH du fer pour $c={{10}^{-2}}mole.{{l}^{-1}}$ .
Etude des équilibres de précipitation
$Fer(+II)\text{ }\to Fe{{\left( OH \right)}_{2}}_{\downarrow }$
$\begin{align}& Fe{{(OH)}_{2}}{{\,}_{\downarrow }}\,\leftrightarrow F{{e}^{2+}}+2O{{H}^{-}}\ \ \ \ \ \ {{K}_{s}}={{10}^{-15.1}}=[F{{e}^{2+}}]\cdot {{[O{{H}^{-}}]}^{2}}=[F{{e}^{2+}}]\cdot \frac{K_{e}^{2}}{{{[{{H}^{+}}]}^{2}}} \\& [F{{e}^{2+}}]=\frac{{{K}_{s}}}{K_{e}^{2}}\cdot {{[{{H}^{+}}]}^{2}}\ \ \ d'o\grave{u}\ \ \ \ \log [F{{e}^{2+}}]=-2pH+12.9 \\\end{align}$
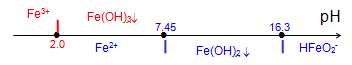
donc $\,p{{H}_{1}}=6.45-{\scriptstyle{}^{1}/{}_{2}}\log c$
Si $\left[ \text{F}{{\text{e}}^{\text{2+}}} \right]\text{=1}{{\text{0}}^{\text{-2}}}\text{mole}\text{.}{{\text{l}}^{\text{-1}}}$ , le premier grain de $\text{Fe}{{\left( \text{OH} \right)}_{\text{2}}}$ apparaît à pH1=7.45 (6.45 pour $\left[ \text{F}{{\text{e}}^{\text{2+}}} \right]\text{=1 }\!\!~\!\!\text{ M}$ ).
On peut aussi tenir compte de l'équilibre de redissolution de $\text{Fe}{{\left( \text{OH} \right)}_{\text{2}}}$ :
$$Fe{{(OH)}_{2}}{{\,}_{\downarrow \,}}\,\leftrightarrow HFeO_{2}^{-}+{{H}^{+}}\ \ \ \ \ \ ;\,\,\,K={{10}^{-18.3}}=[HFeO_{2}^{-}]\cdot [{{H}^{+}}]\,\,;\ \ \ \ \ \ \ \ \ \ \ \ d'o\grave{u}\,\,\ \ \ \log [HFeO_{2}^{-}]=pH-18.3$$
donc $\,p{{H}_{2}}=18.3+\log c$
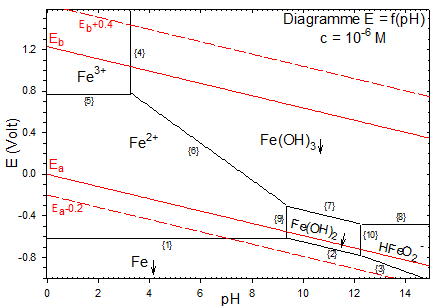
Si $\left[ F{{e}^{2+}} \right]={{10}^{-2}}mole.{{l}^{-1}}$ , le dernier grain de $Fe{{\left( OH \right)}_{2}}$ se redissout en formant $\text{HFeO}_{\text{2}}^{\text{-}}$ à pH2=16.3 ce qui n'est pas visible sur le diagramme (mais à pH2=12.3 si $\text{c=1}{{\text{0}}^{\text{-6}}}\text{mole}\text{.}{{\text{l}}^{\text{-1}}}$ comme dans le cas du diagramme de corrosion du fer).
$Fer(+III)\text{ }\to Fe{{\left( OH \right)}_{3}}_{\downarrow }$
$\begin{align}& Fe{{(OH)}_{3}}{{\,}_{\downarrow }}\,\leftrightarrow F{{e}^{3+}}+3O{{H}^{-}}\ \ \ \ \ \ {{K}_{s}}={{10}^{-38}}=[F{{e}^{3+}}]\cdot {{[O{{H}^{-}}]}^{3}}=[F{{e}^{3+}}]\cdot \frac{K_{e}^{2}}{{{[{{H}^{+}}]}^{3}}} \\& \ \ [F{{e}^{3+}}]=\frac{{{K}_{s}}}{K_{e}^{2}}\cdot {{[{{H}^{+}}]}^{3}}\ \ \ d'o\grave{u}\ \ \ \ \log [F{{e}^{3+}}]=-3pH+4 \\\end{align}$
donc $p{{H}_{3}}=1.333-{\scriptstyle{}^{1}/{}_{3}}\log c$
Si $\left[ \text{F}{{\text{e}}^{\text{3+}}} \right]\text{=1}{{\text{0}}^{\text{-2}}}\text{mole}\text{.}{{\text{l}}^{\text{-1}}}$ , le premier grain de $\text{Fe}{{\left( \text{OH} \right)}_{\text{3}}}$ apparaît à pH3=2 (1.33 pour $\left[ \text{F}{{\text{e}}^{\text{3+}}} \right]\text{=1 }\!\!~\!\!\text{ M}$ )
Etude des potentiels dans les intervalles de pH
$\text{F}{{\text{e}}^{\text{2+}}}\text{/Fe }\!\!~\!\!\text{ }\text{, Fe}{{\left( \text{OH} \right)}_{\text{2}}}\text{/Fe }\text{, HFe}{{\text{O}}_{\text{2}}}^{\text{-}}\text{/Fe}$
$\begin{align}& \oplus \,\ \ pH<p{{H}_{1}}\,\,\,(p{{H}_{1}}=7.45)\ \ \ \ \ \,\,Couple\ \,\,\ \ F{{e}^{2+}}/Fe\ \ \ :\,\,\,\,\,\,\,\,\,\ \ \ \ F{{e}^{2+}}+2{{e}^{-}}\leftrightarrow Fe\ \ \ \ \ \ E_{F{{e}^{2+}}/Fe}^{0}=-0.44\ \,Volt \\& \ \ \ \ \,\,\,\,\,{{E}_{1}}=\ E_{F{{e}^{2+}}/Fe}^{0}+\frac{0.059}{2}\cdot \log [F{{e}^{2+}}]\ \,\,\,\,\,\,\,\,\ \ \ \ \ \ \ \ \ sur\ \,\,la\,\,\ droite\ \,\,[F{{e}^{2+}}]=c \\\end{align}$
$\begin{align}& \ \ \ \ \,\,\,\,\,{{E}_{1}}=\ -0.44+\frac{0.059}{2}\cdot \log c\ \ \ \ \,\,\,\ \ (on\ \,\,trace\ \,\,pour\ \,\,\ c=0.01\ \,mole.{{l}^{-1}}) \\& \ \ \,\,\,\,\,\ \ {{E}_{1}}=\ -0.499\ \,Volt \\\end{align}$
$\begin{align}& \oplus \,\ \ p{{H}_{1}}<pH<p{{H}_{2}}\ \ \ \ \,(p{{H}_{2}}\ =16.3)\,\,\,\,\,\ Couple\ \ \ \,\,Fe{{(OH)}_{2}}_{\downarrow }/F{{e}_{s}}\ :\ \ \ \ \,\,\,\,\,\,\,\,\,\ \ \ \ \ \ Fe{{(OH)}_{2}}_{\downarrow }+2{{e}^{-}}+2{{H}^{+}}\leftrightarrow F{{e}_{s}}+2{{H}_{2}}O\ \ \ \ \ \\& \ \ \,\,\,\,\,\ \ {{E}_{2}}=E_{Fe{{(OH)}_{2}}/Fe}^{0}+\frac{0.059}{2}\log \frac{[Fe{{(OH)}_{2}}_{\downarrow }]\cdot {{[{{H}^{+}}]}^{2}}}{[F{{e}_{s}}]}=E_{Fe{{(OH)}_{2}}/Fe}^{0}-0.059pH\equiv E_{F{{e}^{2+}}/Fe}^{0}+\frac{0.059}{2}\log [F{{e}^{2+}}]\ \ \\& \ \ \ \ \ \,\,\,\,\,\,\,\,\,\,\,avec\,\,\ \ \ \ \ [F{{e}^{2+}}]=\frac{{{K}_{s}}}{K_{e}^{2}}\cdot {{[{{H}^{+}}]}^{2}}\ \ \ \\& \ \ \,\,\,\,\,\,\ \ E_{Fe{{(OH)}_{2}}/Fe}^{0}=E_{F{{e}^{2+}}/Fe}^{0}+\frac{0.059}{2}(2p{{K}_{e}}-p{{K}_{s}})=-0.44+\frac{0.059}{2}(28-15.1)=-0.06\,\ Volt\ \,\,\,\, \\\end{align}$
$$\ \ \,\,\,\,\,\,\ \ {{E}_{2}}=-0.06-0.059pH\ \ \ \,\,\,\,\,\,\ \ \ (ind\acute{e}pendant\ \,\,de\,\,\ c)$$
$\begin{align}& \oplus \,\ \ pH>p{{H}_{2}}\ \ \ \ \,(p{{H}_{2}}\ =16.3)\,\,\,\,\,\ Couple\ \ \ \,\,HFeO_{2}^{-}/F{{e}_{s}}\ :\ \ \ \ \,\,\,\,\,\,\,\,\,\ \ \ \ \ HFeO_{2}^{-}+3{{e}^{-}}+2{{H}^{+}}\leftrightarrow F{{e}_{s}}+2{{H}_{2}}O\ \ \ \ \ \\& \ \ \,\,\,\,\,\ \ {{E}_{3}}=E_{HFeO_{2}^{-}/Fe}^{0}+\frac{0.059}{2}\log \frac{[HFeO_{2}^{-}]\cdot {{[{{H}^{+}}]}^{3}}}{[F{{e}_{s}}]}=E_{HFeO_{2}^{-}/Fe}^{0}-0.0885\,pH+\frac{0.059}{2}\log \,\,c\ \ \\& \grave{a}\,\,pH=p{{H}_{2}}\ =18.3+\log \,c\,\,\,on\,\,a\,\,:\,\,\,{{E}_{2}}={{E}_{3}}\,\,\,\,soit\,\,\,\,\,E_{HFeO_{2}^{-}/Fe}^{0}=0.480\,Volt \\\end{align}$
$$\,{{E}_{3}}=0.480\,-0.0885\,pH+0.0295\,\,\log \,\,c\ \ $$
$\text{F}{{\text{e}}^{\text{3+}}}\text{/F}{{\text{e}}^{\text{2+}}}\text{ }\!\!~\!\!\text{ }\text{, Fe}{{\left( \text{OH} \right)}_{\text{3}}}\text{/F}{{\text{e}}^{\text{2+}}}\text{ }\!\!~\!\!\text{ }\text{, Fe}{{\left( \text{OH} \right)}_{\text{3}}}\text{/Fe}{{\left( \text{OH} \right)}_{\text{2}}}\text{et Fe}{{\left( \text{OH} \right)}_{\text{3}}}\text{/HFeO}_{\text{2}}^{\text{-}}$
$\begin{align}& \oplus \ \ \,pH<p{{H}_{3}}\,\,(p{{H}_{3}}=2)\,\,\,\ \ \ \ \ \ \ \ \ \ \ \ Couple\,\,\ \ \ F{{e}^{3+}}/F{{e}^{2+}}\ \ \ \ \ \,\,;\,\,\,\,\,\,\ \ \ F{{e}^{3+}}+{{e}^{-}}\leftrightarrow F{{e}^{2+}}\ \ \ \ \ \ \ \ \ \ E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}=0.77\ \,Volt \\& \ \ \,\,\,\,\ \ {{E}_{5}}=E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}+0.059\cdot \log \frac{[F{{e}^{3+}}]}{[F{{e}^{2+}}]}\ \ \ \ \ \ \ \ avec\,\,\ \ [F{{e}^{3+}}]+[F{{e}^{2+}}]=c\ \ \ \ \,\,\,;\,\,\,\,\ \ (A.N.\ \ \ \,\,c=0.01\,\,mole.{{l}^{-1}}) \\& \ \ \ \ \,\,\,\,\,\,sur\ \,\,la\ \,\,fronti\grave{e}re\,\,\ (droite)\ \,\,F{{e}^{3+}}/F{{e}^{2+}}\ on\,\,\ a:\ \ [F{{e}^{3+}}]=[F{{e}^{2+}}]={}^{c}/{}_{2}\ \,\,\ et\ \,\,\,\ \log \frac{[F{{e}^{3+}}]}{[F{{e}^{2+}}]}=0\ \ \ \\\end{align}$
$$\ \ {{E}_{5}}=\ E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}=0.77\,\ Volt\ \ \ \ \,(ind\acute{e}pendant\,\,\ de\,\,\ c)\ \ $$
$\begin{align}& \oplus \ \ \,p{{H}_{3}}<pH<p{{H}_{1}}\ \,\ \,(p{{H}_{3}}=2\,;\,\,\,p{{H}_{1}}=7.45)\,\,\,\ \ Couple\ \ \ \,\,Fe{{(OH)}_{3}}_{\downarrow }/F{{e}^{2+}}\,\,\,\ ;\,\,\,\,\ \ \ \ Fe{{(OH)}_{3}}_{\downarrow }+{{e}^{-}}+3{{H}^{+}}\leftrightarrow F{{e}^{2+}}+3{{H}_{2}}O\ \ \ \ \ \\& \ \ \ \ \,\,\,\,{{E}_{6}}=E_{Fe{{(OH)}_{3}}/F{{e}^{2+}}}^{0}+0.059\cdot \log \frac{{{[{{H}^{+}}]}^{3}}}{[F{{e}^{2+}}]}=E_{Fe{{(OH)}_{3}}/F{{e}^{2+}}}^{0}-0.177pH-0.059\cdot \log [F{{e}^{2+}}] \\& \,\,\,\,\ \ \ \ {{E}_{6}}\equiv E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}+0.059\cdot \log \frac{[F{{e}^{3+}}]}{[F{{e}^{2+}}]}\ \ \ \ \ \ \ \ \ mais\ \ [F{{e}^{3+}}]=\frac{{{K}_{s(Fe{{(OH)}_{3}})}}}{K_{e}^{3}}\cdot {{[{{H}^{+}}]}^{3}}\ \ \ \\& \ \ \ \ \ \ \,\,\,\,\,donc\ \,\,\ \ E_{Fe{{(OH)}_{3}}/F{{e}^{2+}}}^{0}=E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}-0.059p{{K}_{s}}+0.177p{{K}_{e}}\ =0.77-0.059*38+0.177*14=1.006\ Volt \\& \,\,\,\,\ \ \ \ {{E}_{6}}=1.006-0.177pH\ -0.059\cdot \log [F{{e}^{2+}}]\ \ \ \ \ \,\ sur\,\,\ la\ \,\,fronti\grave{e}re\ \,(droite)\ \,\,Fe{{(OH)}_{3}}_{\downarrow }/F{{e}^{2+}}\ \ \,:\,\,\ \ \ [F{{e}^{2+}}]=c \\\end{align}$
$$\ \ {{E}_{6}}=1.006-0.177pH\ -0.059\cdot \log c$$
$\begin{align}& \oplus \ \ \,p{{H}_{1}}<pH<p{{H}_{2}}\,\,(p{{H}_{1}}=7.45\ \ \,\,;\,\,p{{H}_{2}}=16.3)\,\ \ \ \,Couple\ \ \ \,\,Fe{{(OH)}_{3}}/Fe{{(OH)}_{2}}\ \ :\ \ \ Fe{{(OH)}_{3}}_{\downarrow }+{{e}^{-}}+{{H}^{+}}\leftrightarrow Fe{{(OH)}_{2}}_{\downarrow }\ \ +{{H}_{2}}O \\& \ \ \ \ \,\,\,\,\,{{E}_{7}}=E_{Fe{{(OH)}_{3}}/Fe{{(OH)}_{2}}}^{0}\underbrace{+0.059\cdot \log \frac{Fe{{(OH)}_{3}}_{\downarrow }}{Fe{{(OH)}_{2}}_{\downarrow }}}_{0}-0.059pH\equiv E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}+0.059\cdot \log \frac{[F{{e}^{3+}}]}{[F{{e}^{2+}}]} \\& \ \ \ \ \ \,\,\,\,avec\ \ \,\,[F{{e}^{3+}}]=\frac{{{K}_{s(Fe{{(OH)}_{3}})}}}{K_{e}^{3}}\cdot {{[{{H}^{+}}]}^{3}}\,\ \ \ et\,\,\ \ \ [F{{e}^{2+}}]=\frac{{{K}_{s(Fe{{(OH)}_{2}})}}}{K_{e}^{2}}\cdot {{[{{H}^{+}}]}^{2}} \\\end{align}$
$\begin{align}& \ \ \ \ \,\,\,\,{{E}_{7}}=E_{Fe{{(OH)}_{3}}/Fe{{(OH)}_{2}}}^{0}-0.059pH=E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}+0.059\cdot \log \left\{ \frac{{{K}_{s(Fe{{(OH)}_{3}})}}}{K_{e}^{3}}\cdot {{[{{H}^{+}}]}^{3}}\cdot \frac{K_{e}^{2}}{{{K}_{s(Fe{{(OH)}_{2}})}}\cdot {{[{{H}^{+}}]}^{2}}} \right\} \\& \ \ \,\,\,\,\ \ E_{Fe{{(OH)}_{3}}/Fe{{(OH)}_{2}}}^{0}=E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}+0.059\cdot (p{{K}_{s(Fe{{(OH)}_{2}})}}-{{K}_{s(Fe{{(OH)}_{3}})}}+p{{K}_{e}})=0.77+0.059\cdot (15.1-38+14)=0.245\,Volt \\\end{align}$
$$\ \ \ \ \,\ {{E}_{7}}=0.245-0.059\,\,pH\,\,\,\,\,(ind\acute{e}pendant\,\,de\,\,c)$$
$\begin{align}& \oplus \ \ \,pH>p{{H}_{2}}\,\,(\,p{{H}_{2}}=16.3)\,\ \ \ \,Couple\ \ \ \,\,Fe{{(OH)}_{3}}_{\downarrow }/HFeO_{2}^{-}\ \ \,\,\,\,:\ \,\,\,\,\,\,\,\,\,\,\,\,\ \ Fe{{(OH)}_{3}}_{\downarrow }+{{e}^{-}}\leftrightarrow HFeO_{2}^{-}\ \ \ +{{H}_{2}}O \\& \ \ \ \ \,\,\,\,\,{{E}_{8}}=E_{Fe{{(OH)}_{3}}/HFeO_{2}^{-}}^{0}-0.059\,\log \,c\,\,\,\,\,\,\,\grave{a}\,\,\,pH>p{{H}_{2}}\,\,\,on\,\,a\,\,\,:\,\,{{E}_{8}}={{E}_{7}}\,\,\,\,\,soit\,\,\,\,{{E}_{8}}=-0.835\,Volt \\\end{align}$
$$\,{{E}_{8}}=-0.835-0.059\,\log \,c$$
Les droites {4} et {9} correspondent aux pH de précipitation des hydroxydes et la droite {10} correspond à la redissolution de $\text{Fe}{{\left( \text{OH} \right)}_{\text{2}}}$ pour former $\text{HFeO}_{\text{2}}^{\text{-}}$
${{\text{H}}^{\text{+}}}\text{/}{{\text{H}}_{\text{2}}}\text{ et }{{\text{O}}_{\text{2}}}\text{/}{{\text{H}}_{\text{2}}}\text{O}$
$\begin{align}& \oplus \ \ \,Couple\ \ \,\,{{H}^{+}}/{{H}_{2}}\ \ :\ \ \,\,\,\,\,\,\,\,\,\,\,2{{H}^{+}}+2{{e}^{-}}\leftrightarrow {{H}_{2(g)}}\ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ E_{{{H}^{+}}/{{H}_{2}}}^{0}=0\,\ \ \ Volt \\& \ \ \ \,\,\,\,\,\,{{E}_{a}}=\ \underbrace{\,E_{{{H}^{+}}/{{H}_{2}}}^{0}}_{0}+0.059\cdot (\log [{{H}^{+}}]-\log p_{{{H}_{2(g)}}}^{1/2}) \\\end{align}$
$$\ \ {{E}_{a}}=-0.059\,pH\ \ \ \ \ \ \ \ \ (si\,\,\ {{p}_{{{H}_{2(g)}}}}=1atm)$$
$\begin{align}& \oplus \ \ \,Couple\,\,\ \ {{O}_{2}}/{{H}_{2}}O\,\ :\ \ \,\,\,\,\,\,\ \,{{O}_{2(g)}}\ +4{{e}^{-}}+4{{H}^{+}}\leftrightarrow 2{{H}_{2}}O\ \ \ \ \ \ \ E_{{{O}_{2}}/{{H}_{2}}O}^{0}=1.229\ Volt\ \ \ \\& \ \ \ \ \,\,\,\,\,{{E}_{b}}=E_{{{O}_{2}}/{{H}_{2}}O}^{0}+\frac{0.059}{4}\cdot (\log {{[{{H}^{+}}]}^{4}}-\log p_{{{O}_{2(g)}}}^{1/2})\,\,\,=\,\,\,E_{{{O}_{2}}/{{H}_{2}}O}^{0}-0.059\,\,pH\,\,\,\,\,\ \ (si\ \,\,\ {{p}_{{{O}_{2(g)}}}}=1\,atm) \\\end{align}$
$$\ {{E}_{b}}=1.229-0.059\,pH$$
Pour des raisons cinétiques : ${{\text{E}}_{\text{b}}}\text{+0}\text{.4 Volt}\le \text{zone de stabilit }\!\!\acute{\mathrm{e}}\!\!\text{ de l }\!\!'\!\!\text{ eau}\le {{\text{E}}_{\text{a}}}\text{-0}\text{.2 Volt}$.
Diagramme potentiel pH du fer (c=10-2mole.l-1)
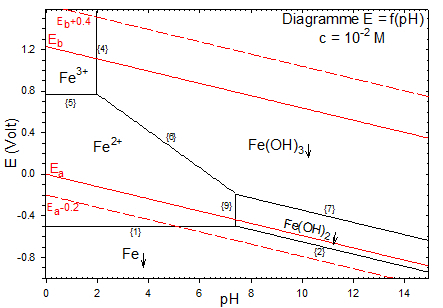
Diagramme de corrosion du fer (c=10-6mole.l-1)