Les métaux carbonyles
Exemple 1 : $\text{Ni}{{\left( \text{CO} \right)}_{\text{4}}}$ , nickel carbonyle, $Ni+4CO\,\to Ni{{(CO)}_{4}}$ à 30°C et P = 1atm. $\begin{matrix}Ni & 3{{d}^{8}}4{{s}^{2}} & (10{{e}^{-}}) \\4CO & 4x2{{e}^{-}} & (8{{e}^{-}}) \\{} & Total & 18{{e}^{-}} \\\end{matrix}$ |  |

Rappel sur CO :
|  |
Exemple 2 : $\text{Cr}{{\left( \text{CO} \right)}_{\text{6}}}$ , chrome carbonyle $\begin{matrix}Cr & 3{{d}^{5}}4{{s}^{1}} & (6{{e}^{-}}) \\6CO & 6x2{{e}^{-}} & (12{{e}^{-}}) \\{} & Total & 18{{e}^{-}} \\\end{matrix}$ Structure octaédrique, hybridation $\text{s}{{\text{p}}^{\text{3}}}{{\text{d}}^{\text{2}}}$ pour Cr, composé paramagnétique |  |
Exemple 3 : $\text{Co}{{\left( \text{CO} \right)}_{\text{4}}}$ , cobalt carbonyle , composé paramagnétique ; $\begin{matrix}Co & 3{{d}^{7}}4{{s}^{2}} & (9{{e}^{-}}) \\4CO & 4x2{{e}^{-}} & (8{{e}^{-}}) \\{} & Total & 17{{e}^{-}} \\\end{matrix}$ Il manque un électron, la molécule se dimérise en formant une liaison courte Co-Co -> $\text{C}{{\text{o}}_{\text{2}}}{{\left( \text{CO} \right)}_{\text{8}}}$ | 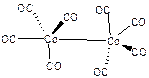 |
Exemple 4 : $\text{Fe}{{\left( \text{CO} \right)}_{\text{5}}}$ , fer carbonyle $Fe+5CO \rightleftarrows Fe{{(CO)}_{5}}$, à 180°C, 200 atm, liquide jaune $\begin{matrix}Fe & 3{{d}^{6}}4{{s}^{2}} & (8{{e}^{-}}) \\5CO & 5x2{{e}^{-}} & (10{{e}^{-}}) \\{} & Total & 18{{e}^{-}} \\\end{matrix}$ Hybridation $\text{ds}{{\text{p}}^{\text{3}}}$ , composé diamagnétique. |  |
Il existe aussi les complexes $\text{F}{{\text{e}}_{\text{2}}}{{\left( \text{CO} \right)}_{\text{9}}}$ et $\text{F}{{\text{e}}_{\text{3}}}{{\left( \text{CO} \right)}_{\text{12}}}$ pour lesquels des liaisons Fe-Fe et des liaisons pont Fe-CO-Fe apparaissent. $\text{F}{{\text{e}}_{\text{2}}}{{\left( \text{CO} \right)}_{\text{9}}}$ (solide brun) : $2\,Fe{{(CO)}_{5}}\,\xrightarrow{h\nu }\,\,F{{e}_{2}}{{(CO)}_{9}}+CO\,$, le fer est hybridé $\text{s}{{\text{p}}^{\text{3}}}{{\text{d}}^{\text{3}}}$ $\begin{matrix}{} & Fe & 3{{d}^{6}}4{{s}^{2}} & (8{{e}^{-}}) \\{} & Fe\leftrightarrow Fe & 1{{e}^{-}} & (1{{e}^{-}}) \\{} & 3Fe\leftrightarrow C & 3x1{{e}^{-}} & (3{{e}^{-}}) \\{} & {} & Total & 18{{e}^{-}} \\\end{matrix}$ autour de chaque fer. $\text{F}{{\text{e}}_{\text{3}}}{{\left( \text{CO} \right)}_{\text{12}}}$ (solide vert foncé) : $\tfrac{3}{2}F{{e}_{2}}{{(CO)}_{9}}\,\xrightarrow{\Delta }\,\,F{{e}_{3}}{{(CO)}_{12}}+\tfrac{3}{2}CO\,$, (on remplace un groupement =CO par $\text{Fe}{{\left( \text{CO} \right)}_{\text{4}}}$ à partir du complexe précédent). | 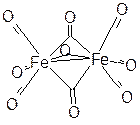 |
Fondamental :
Dans tous ces métaux-carbonyles , le métal est entouré par 18 électrons de valence.




