Les électrodes types
Les métaux et les espèces précipitées ont toujours une concentration = 1 (activité = 1). Le potentiel d'une demi-pile est donné par l'équation de Nernst.
Electrode du 1er Type
Electrode Métal-Ion :
Un métal plonge dans une solution d'un de ses sels. On retrouve l'expression de Nernst :
$${{M}^{n+}}+n{{e}^{-}}\rightleftarrows M\ \ \ \ avec\ \ \ \ [M]=1\ ,\ alors\ \ \ \ \ E=E_{{{M}^{n+}}/M}^{0}+\frac{0.059}{n}\log [{{M}^{n+}}]$$
Exemple : Quel est le potentiel d'une électrode de zinc plongée dans une solution ${{10}^{-3}}M$ de sulfate de zinc ?
$$\ [Z{{n}^{2+}}]={{10}^{-3}}\ ,\ \ \ n=2\ \ ,\ \ E_{Z{{n}^{2+}}/Zn}^{0}=-0.76\ Volt\ \ \ \ \ donc\ \ \ \ \ E=-0.76+\frac{0.059}{2}\log {{10}^{-3}}=-0.85\ Volt$$
Electrode à gaz
Un gaz est en équilibre au dessus d'une solution qui contient sa forme oxydée ou réduite
Electrode à hydrogène:, on a
$${{H}^{+}}+{{e}^{-}}\rightleftarrows {\scriptstyle{}^{1}/{}_{2}}{{H}_{2}}\ $et $E=E_{{{H}^{+}}/{{H}_{2}}}^{0}+0.059\cdot (\log [{{H}^{+}}]-\log p_{{{H}_{2}}}^{{\scriptstyle{}^{1}/{}_{2}}})$$
c'est à dire : $E=-0.059\cdot (pH+{\scriptstyle{}^{1}/{}_{2}}\log {{p}_{{{H}_{2}}}})$.
L'électrode normale est telle que ${{p}_{{{H}_{2}}}}=1\ atm$ donc $E=-0.059\cdot pH$
Electrode à oxygène : Lame de platine servant d'anode dans l'électrolyse de l'acide sulfurique dilué (${{O}_{2}}/{{H}_{2}}O$ ) :
$$\begin{align}& {{O}_{2(g)}}+4{{H}^{+}}+4{{e}^{-}}\rightleftarrows 2{{H}_{2}}O\ \ \ \ \ \ et\ \ \ \ \ \ E=E_{{{O}_{2(g)}}/{{H}_{2}}O}^{0}+\frac{0.059}{4}\cdot \log (p{{O}_{2}}{{[{{H}^{+}}]}^{4}})\ \ \ \ avec\ \ E_{{{O}_{2(g)}}/{{H}_{2}}O}^{0}=1.229\ Volt \\& \ E=E_{{{O}_{2(g)}}/{{H}_{2}}O}^{0}-0.059pH+\frac{0.059}{4}\cdot \log p{{O}_{2}}\ \ \ :\ \ \ \ \grave{a}\ pH=7\ (eau\ pure,p{{O}_{2}}\ =1\ atm)\ \ \ \ E=0.815\ Volt \\\end{align}$$
Electrode anionique
L'électrode est constituée d'un métal au contact d'un de ses sels halogénés ($C{{l}^{-}}\text{ }ou\text{ }B{{r}^{-}}$ ) peu soluble. Par exemple :
| 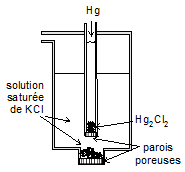 |
Dans le cas de l'électrode au calomel, les équilibres concernés sont :
$$\begin{align}& \ Hg_{2}^{2+}+2{{e}^{-}}\rightleftarrows 2Hg\ \ \ \ \ \ \ \ \ \ \ \ \ \text{ }\ \ \ \ \ \left\{ 1 \right\}\ \ \ \ {{E}_{1}}=E_{^{Hg_{2}^{2+}/Hg}}^{0}+{\scriptstyle{}^{0.059}/{}_{2}}\log [Hg_{2}^{2+}] \\& \ \ \ \ \ \ \ \underline{H{{g}_{2}}C{{l}_{2}}\rightleftarrows Hg_{2}^{2+}+2C{{l}^{-}}\ \ \ \ \ \ \ }\ \ \left\{ 2 \right\}\ \ \ \ {{K}_{s}}\ =[Hg_{2}^{2+}]\cdot {{[C{{l}^{-}}]}^{2}} \\& H{{g}_{2}}C{{l}_{2}}+2{{e}^{-}}\rightleftarrows 2Hg+2C{{l}^{-}}\ \ \ \ \ \ \ \ \ \left\{ 3 \right\}\ \ \ \ {{E}_{3}}=E_{Hg/H{{g}_{2}}C{{l}_{2}}/C{{l}^{-}}}^{0}-{\scriptstyle{}^{0.059}/{}_{2}}\log {{[C{{l}^{-}}]}^{2}} \\\end{align}$$
En identifiant (E1=E3), il vient :
$$\begin{align}& E_{Hg/H{{g}_{2}}C{{l}_{2}}/C{{l}^{-}}}^{0}-E_{^{Hg_{2}^{2+}/Hg}}^{0}={\scriptstyle{}^{0.059}/{}_{2}}\log {{[C{{l}^{-}}]}^{2}}+{\scriptstyle{}^{0.059}/{}_{2}}\log [Hg_{2}^{2+}]\ \ \\& avec\ \ E_{Hg/H{{g}_{2}}C{{l}_{2}}/C{{l}^{-}}}^{0}=E_{^{Hg_{2}^{2+}/Hg}}^{0}-{}^{0.059}/{}_{2}p{{K}_{s}} \\\end{align}$$
$$\begin{align}& Avec\ \ E_{^{Hg_{2}^{2+}/Hg}}^{0}=0.792\ Volt\ \ et\ \ p{{K}_{s}}=17.74\ ({{K}_{s}}=1.8\ {{10}^{-18}}), \\& \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ E_{Hg/H{{g}_{2}}C{{l}_{2}}/C{{l}^{-}}}^{0}=0.268\ Volt \\\end{align}$$
Ce sont en fait des électrodes à $C{{l}^{-}}$ (anioniques) et les potentiels standards sont dépendants de la concentration en KCl du pont ionique.
En pratique, ces électrodes sont utilisées comme électrode de référence sous 2 formes :
Electrodes combinées (2 électrodes dont une de référence : $Ag\left| AgCl \right.\left| KC{{l}_{s}}\left| {} \right. \right.\ \ ;\ KCl\ 3M\ ;\ E_{Ag{{\left| AgCl \right.}^{-}}}^{0}=\ 0.222Volt$)
Electrode de référence (électrode au calomel,) $Hg\left| H{{g}_{2}}C{{l}_{2}} \right.\left| KCl\left| {} \right. \right.\ \ ;\ KCl\ satur\acute{e}\ ,\ E_{Hg/H{{g}_{2}}C{{l}_{2}}/C{{l}^{-}}}^{0}=0.268\ Volt$
Electrode du 3ème type : Electrode redox
Une électrode d'un métal inerte (Platine) plonge dans une solution redox (exemple: mélange Fe3+/Fe2+).
On a alors l'expression du potentiel d'électrode :
$$Pour\ la\ demi\ reaction:\ \ \ ox+n{{e}^{-}}\rightleftarrows red\ \ \ \ \ \ \ \ \ \ E=E_{ox/red}^{0}+\frac{0.059}{n}\cdot \log \frac{\left[ ox \right]}{\left[ red \right]}$$
Exemple : Solution contenant ${{10}^{-2}}mole/l\text{ }ions\text{ }F{{e}^{2+}}~et\text{ }{{10}^{-1}}mole/l\text{ }ions\text{ }~F{{e}^{3+}}$ .
$$\ [F{{e}^{3+}}]={{10}^{-1}}\ ,\ [F{{e}^{2+}}]={{10}^{-2}}\ ,\ \ \ n=1\ \ ,\ \ E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}=0.77\ Volt\ \ \ \ \ donc\ \ \ \ \ E=0.77+0.059\cdot \log \frac{{{10}^{-1}}}{{{10}^{-2}}}=0.829\ Volt$$
Electrodes du 4ème type : les électrodes spécifiques
Ces électrodes mesurent l'activité d'un ion. L'expression du potentiel est du type : $\ E=A+\frac{RT}{zF}\cdot Log\ {{x}_{{{F}^{-}}}}\ \ $ avec A=Cte, z charge de l'ion, x étant l'activité de l'ion dont on cherche la concentration. L'électrode à ion ${{F}^{-}}$ utilise une membrane solide (un cristal de $La{{F}_{3}}:E{{u}^{2+}}$, conducteur ${{F}^{-}}$). Les ions ${{F}^{-}}$ peuvent être échangés entre le cristal et la solution aqueuse dont on veut mesurer la concentration en ${{F}^{-}}$. Il n'y a pas de réaction d'oxydo-réduction. | 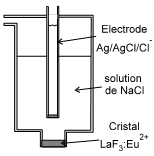 |




