Les facteurs influant sur le potentiel d'oxydo-reduction
Le pH
Par exemple, en milieu acide : $MnO_{4}^{-}+8{{H}^{+}}+5{{e}^{-}}\rightleftarrows M{{n}^{2+}}+4{{H}_{2}}O$ avec $E_{MnO_{4}^{-}/M{{n}^{2+}}}^{0}=1.51\ Volt$ : $$\begin{align}& E=E_{MnO_{4}^{-}/M{{n}^{2+}}}^{0}+\frac{0.059}{5}\log \frac{{{[{{H}^{+}}]}^{8}}\cdot [MnO_{4}^{-}]}{[M{{n}^{2+}}]} \\& E=\underbrace{E_{MnO_{4}^{-}/M{{n}^{2+}}}^{0}-\frac{0.059*8}{5}pH}_{E_{0}^{'}}+\frac{0.059}{5}\log \frac{[MnO_{4}^{-}]}{[M{{n}^{2+}}]} \\\end{align}$$ ${{E}^{'0}}$ est le potentiel normal apparent, il varie avec le pH, on voit la conséquence dans le cas du dosage redox de $F{{e}^{2+}}$ ($E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}=0.77\ Volt$) : | 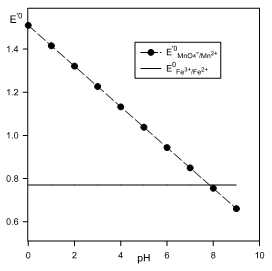 |
$$\begin{align}& \ \ MnO_{4}^{-}+8{{H}^{+}}+5{{e}^{-}}\rightleftarrows M{{n}^{2+}}+4{{H}_{2}}O\ \ \ \ \ \ \ \ \ \ \ \ \ \ (1) \\& \underline{\ \ \ \ \ \ \ \ \ \ \ \ \ F{{e}^{3+}}+{{e}^{-}}\rightleftarrows F{{e}^{2+}}\ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ }\ \ (-5)\ \\& MnO_{4}^{-}+8{{H}^{+}}+5F{{e}^{2+}}\rightleftarrows M{{n}^{2+}}+5F{{e}^{3+}}+4{{H}_{2}}O \\\end{align}$$
On constate que le potentiel varie et qu'à partir d'un pH voisin de 8, c'est le couple du fer qui devient oxydant.
En fait, à partir de $pH\approx 2$ le fer précipite sous forme $Fe{{\left( OH \right)}_{3}}$ ce qui modifie les conditions.
La précipitation
En général, la précipitation d'un hydroxyde diminue le pouvoir oxydant :
$$\begin{align}& F{{e}^{3+}}+{{e}^{-}}\rightleftarrows F{{e}^{2+}}\ \ \ \ \ \ E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}=0.77\ Volt\ \\& \ \ d\grave{e}s\ que\ pH>2\ \ \ pour\ \ {{c}_{0}}={{10}^{-2}}mole.{{l}^{-1}}\ \ \ \ Fe{{(OH)}_{3}}\ pr\acute{e}cipite: \\& Fe{{(OH)}_{3}}+{{e}^{-}}+3{{H}^{+}}\leftrightarrow F{{e}^{2+}}+3{{H}_{2}}O\ \ \ et\ \ E=E_{Fe{{(OH)}_{3}}/F{{e}^{2+}}}^{0}+0.059\cdot \log \frac{{{[{{H}^{+}}]}^{3}}}{[F{{e}^{2+}}]}\ \ \ car\ [{{(Fe{{(OH)}_{3}})}_{s}}]=1 \\& E=\underbrace{E_{Fe{{(OH)}_{3}}/F{{e}^{2+}}}^{0}-0.177pH}_{E_{0}^{'}<E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}}-0.059\cdot \log [F{{e}^{2+}}] \\\end{align}$$
Donc le potentiel diminue avec l'augmentation du pH
Les diagrammes de POURBAIX (ou diagrammes potentiel-pH) permettent de suivre l'évolution du système redox avec le pH (et la précipitation éventuelle des phases).
On cherche les droites sur lesquelles [Ox]=[Red], au-dessus de la droite la forme oxydée prédomine .
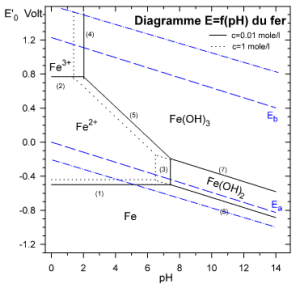
Tracé de E = f(pH) dans le cas du système redox $F{{e}^{3+}}/F{{e}^{2+}}$ (on tracera pour $c={{10}^{-2}}mole.{{l}^{-1}}$ )
a/ Etude des équilibres de précipitation :
$$\begin{align}& Fe{{(OH)}_{2}}\rightleftarrows F{{e}^{2+}}+2O{{H}^{-}}\ \ \ \ \ \ {{K}_{s}}={{10}^{-15.1}}=[F{{e}^{2+}}]\cdot {{[O{{H}^{-}}]}^{2}}=[F{{e}^{2+}}]\cdot \frac{K_{e}^{2}}{{{[{{H}^{+}}]}^{2}}} \\& \ \ \ \ \ \ \ \ \ \ \ \ \ [F{{e}^{2+}}]=\frac{{{K}_{s}}}{K_{e}^{2}}\cdot {{[{{H}^{+}}]}^{2}}\ \ \ d'o\grave{u}\ \ \ \ \log [F{{e}^{2+}}]=-2pH+12.9 \\\end{align}$$
Si $c={{10}^{-2}}mole.{{l}^{-1}}$ [Fe2+]=10-2mole.l-1 , le premier grain de $Fe{{\left( OH \right)}_{2}}$ apparaît à pH=7.45 (6.45 pour $\left[ F{{e}^{2+}} \right]=1~M$ ).
$$\begin{align}& Fe{{(OH)}_{3}}\rightleftarrows F{{e}^{3+}}+3O{{H}^{-}}\ \ \ \ \ \ {{K}_{s}}={{10}^{-38}}=[F{{e}^{3+}}]\cdot {{[O{{H}^{-}}]}^{3}}=[F{{e}^{3+}}]\cdot \frac{K_{e}^{2}}{{{[{{H}^{+}}]}^{3}}} \\& \ \ \ \ \ \ \ \ \ \ \ \ \ [F{{e}^{3+}}]=\frac{{{K}_{s}}}{K_{e}^{2}}\cdot {{[{{H}^{+}}]}^{3}}\ \ \ d'o\grave{u}\ \ \ \ \log [F{{e}^{3+}}]=-3pH+4 \\\end{align}$$
Si $[F{{e}^{3+}}]={{10}^{-2}}mole.{{l}^{-1}}$ , le premier grain de $Fe{{\left( OH \right)}_{3}}$ apparaît à pH=2 (1.33 pour $\left[ F{{e}^{3+}} \right]=1~M$
b/ Etude des potentiels dans les intervalles de pH :
| 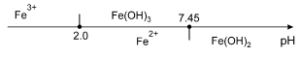 |
$\begin{align}& \oplus \ \ pH<2\ \ \ \ \ \ \ \ \ \ \ \ \ \ Couple\ \ \ F{{e}^{3+}}/F{{e}^{2+}}\ \ \ \ \ \ :\ \ \ \ F{{e}^{3+}}+{{e}^{-}}\rightleftarrows F{{e}^{2+}}\ \ \ \ \ \ \ \ \ \ E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}=0.77\ Volt \\& \ \ \ \ {{E}_{2}}=E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}+0.059\cdot \log \frac{[F{{e}^{3+}}]}{[F{{e}^{2+}}]}\ \ \ \ \ \ \ \ avec\ \ [F{{e}^{3+}}]+[F{{e}^{2+}}]=c\ \ \ \ \ \ (A.N.\ \ \ c=0.01mole.{{l}^{-1}}) \\& \ \ \ \ sur\ la\ fronti\grave{e}re\ (droite)\ F{{e}^{3+}}/F{{e}^{2+}}\ on\ a:\ \ [F{{e}^{3+}}]=[F{{e}^{2+}}]={}^{c}/{}_{2}\ \ et\ \ \log \frac{[F{{e}^{3+}}]}{[F{{e}^{2+}}]}=0 \\& \ \ \ \ {{E}_{2}}=\ E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}=0.77\ Volt\ \ \ \ (ind\acute{e}pendant\ de\ c) \\\end{align}$
$\begin{align}& \oplus \ \ 2<pH<7.45\ \ \ \ \ Couple\ \ \ Fe{{(OH)}_{3}}_{\downarrow }/F{{e}^{2+}}\ :\ \ \ \ Fe{{(OH)}_{3}}_{\downarrow }+{{e}^{-}}+3{{H}^{+}}\rightleftarrows F{{e}^{2+}}+3{{H}_{2}}O\ \ \ \ \ \\& \ \ \ \ {{E}_{5}}=E_{Fe{{(OH)}_{3}}/F{{e}^{2+}}}^{0}+0.059\cdot \log \frac{{{[{{H}^{+}}]}^{3}}}{[F{{e}^{2+}}]}=E_{Fe{{(OH)}_{3}}/F{{e}^{2+}}}^{0}-0.177pH-0.059\cdot \log [F{{e}^{2+}}] \\& \ \ \ \ {{E}_{5}}\equiv E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}+0.059\cdot \log \frac{[F{{e}^{3+}}]}{[F{{e}^{2+}}]}\ \ \ \ \ \ \ \ \ mais\ \ [F{{e}^{3+}}]=\frac{{{K}_{s(Fe{{(OH)}_{3}})}}}{K_{e}^{3}}\cdot {{[{{H}^{+}}]}^{3}}\ \ \ \\& \ \ \ \ \ \ donc\ \ \ E_{Fe{{(OH)}_{3}}/F{{e}^{2+}}}^{0}=E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}-0.059p{{K}_{s}}+0.177p{{K}_{e}}\ =0.77-0.059*38+0.177*14=1.006\ Volt \\& \ \ \ \ {{E}_{5}}=1.006-0.177pH\ -0.059\cdot \log [F{{e}^{2+}}]\ \ \ \ \ \ sur\ la\ fronti\grave{e}re\ (droite)\ Fe{{(OH)}_{3}}_{\downarrow }/F{{e}^{2+}}\ \ \ \ \ [F{{e}^{2+}}]=c \\& \ \ \ \ {{E}_{5}}=1.006-0.177pH\ -0.059\cdot \log c \\& \ \ \ \ {{E}_{5}}=1.124-0.177pH\ \ \ \\\end{align}$
$\begin{align}& \oplus \ \ pH>7.45\ \ \ \ \ Couple\ \ \ Fe{{(OH)}_{3}}/Fe{{(OH)}_{2}}\ \ :\ \ \ Fe{{(OH)}_{3}}_{\downarrow }+{{e}^{-}}+{{H}^{+}}\rightleftarrows Fe{{(OH)}_{2}}_{\downarrow }\ \ +{{H}_{2}}O \\& \ \ \ \ {{E}_{7}}=E_{Fe{{(OH)}_{3}}/Fe{{(OH)}_{2}}}^{0}\underbrace{+0.059\cdot \log \frac{Fe{{(OH)}_{3}}_{\downarrow }}{Fe{{(OH)}_{2}}_{\downarrow }}}_{0}-0.059pH\equiv E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}+0.059\cdot \log \frac{[F{{e}^{3+}}]}{[F{{e}^{2+}}]} \\& \ \ \ \ \ mais\ \ [F{{e}^{3+}}]=\frac{{{K}_{s(Fe{{(OH)}_{3}})}}}{K_{e}^{3}}\cdot {{[{{H}^{+}}]}^{3}}\ \ \ et\ \ \ [F{{e}^{2+}}]=\frac{{{K}_{s(Fe{{(OH)}_{2}})}}}{K_{e}^{2}}\cdot {{[{{H}^{+}}]}^{2}} \\\end{align}$
$\begin{align}& \ \ \ \ {{E}_{7}}=E_{Fe{{(OH)}_{3}}/Fe{{(OH)}_{2}}}^{0}-0.059pH \\& \ \ \ \ {{E}_{7}}=E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}+0.059\cdot \log \left\{ \frac{{{K}_{s(Fe{{(OH)}_{3}})}}}{K_{e}^{3}}\cdot {{[{{H}^{+}}]}^{3}}\cdot \frac{K_{e}^{2}}{{{K}_{s(Fe{{(OH)}_{2}})}}\cdot {{[{{H}^{+}}]}^{2}}} \right\} \\& \ \ \ \ E_{Fe{{(OH)}_{3}}/Fe{{(OH)}_{2}}}^{0}=E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}+0.059\cdot (p{{K}_{s(Fe{{(OH)}_{2}})}}-{{K}_{s(Fe{{(OH)}_{3}})}}+p{{K}_{e}} \\\end{align}$
$$\begin{align}& \ \ \ \ E_{Fe{{(OH)}_{3}}/Fe{{(OH)}_{2}}}^{0}=0.77+0.059\cdot (15.1-38+14) \\& \ \ \ \ \ \ E_{Fe{{(OH)}_{3}}/Fe{{(OH)}_{2}}}^{0}=0.245\ Volt \\& \ \ \ \ {{E}_{7}}=0.245-0.059pH\ \ \ \ \ \ \ \ \ \ \ (ind\acute{e}pendant\ de\ c) \\\end{align}$$
$\begin{align}& \oplus \ \ pH<7.45\ \ \ \ \ Couple\ \ \ F{{e}^{2+}}/Fe\ \ \ : \\& \ \ \ \ F{{e}^{2+}}+2{{e}^{-}}\rightleftarrows Fe\ \ \ \ \ \ E_{F{{e}^{2+}}/Fe}^{0}=-0.44\ Volt \\& \ \ \ \ {{E}_{1}}=\ E_{F{{e}^{2+}}/Fe}^{0}+\frac{0.059}{2}\cdot \log [F{{e}^{2+}}]\ \\& \ \ \ \ \ \ \ \ \ sur\ la\ droite\ [F{{e}^{2+}}]=c \\& \ \ \ \ {{E}_{1}}=\ -0.44+\frac{0.059}{2}\cdot \log c\ \ \ \ \\& \ \ (on\ trace\ pour\ \ c=0.01\ mole.{{l}^{-1}}) \\& \ \ \ \ {{E}_{1}}=\ -0.499\ Volt \\\end{align}$ |
$\begin{align}& \oplus \ \ pH>7.45\ \ \ \ \ Couple\ \ \ Fe{{(OH)}_{2}}_{\downarrow }/F{{e}_{s}}\ :\ \ \ \ \\& \ \ \ \ \ \ Fe{{(OH)}_{2}}_{\downarrow }+2{{e}^{-}}+2{{H}^{+}}\rightleftarrows F{{e}_{s}}+2{{H}_{2}}O\ \ \ \ \ \\& \ \ \ \ {{E}_{6}}=E_{Fe{{(OH)}_{2}}/Fe}^{0}+\frac{0.059}{2}\log \frac{[Fe{{(OH)}_{2}}_{\downarrow }]\cdot {{[{{H}^{+}}]}^{2}}}{[F{{e}_{s}}]}=E_{Fe{{(OH)}_{2}}/Fe}^{0}-0.059pH\equiv E_{F{{e}^{2+}}/Fe}^{0}+\frac{0.059}{2}\log [F{{e}^{2+}}]\ \ \\& \ \ \ \ \ et\ \ \ \ \ [F{{e}^{2+}}]=\frac{{{K}_{s}}}{K_{e}^{2}}\cdot {{[{{H}^{+}}]}^{2}}\ \ \ \\& \ \ \ \ E_{Fe{{(OH)}_{2}}/Fe}^{0}=E_{F{{e}^{2+}}/Fe}^{0}+\frac{0.059}{2}(2p{{K}_{e}}-p{{K}_{s}})=-0.44+\frac{0.059}{2}(28-15.1)=-0.06\ Volt \\& \ \ \ \ {{E}_{6}}=-0.06-0.059pH\ \ \ \ \ \ (ind\acute{e}pendant\ de\ c) \\\end{align}$
${{H}^{+}}/{{H}_{2}}\text{ }et\text{ }{{O}_{2}}/{{H}_{2}}O$
$\begin{align}& \oplus \ \ Couple\ \ {{H}^{+}}/{{H}_{2}}\ \ :\ \ 2{{H}^{+}}+2{{e}^{-}}\rightleftarrows {{H}_{2(g)}}\ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ E_{{{H}^{+}}/{{H}_{2}}}^{0}=0\ \ \ Volt \\& \ \ \ {{E}_{a}}=\ \underbrace{E_{{{H}^{+}}/{{H}_{2}}}^{0}}_{0}+0.059\cdot (\log [{{H}^{+}}]-\log p_{{{H}_{2(g)}}}^{1/2}) \\& \ \ \ {{E}_{a}}==-0.059pH\ \ \ \ \ \ \ \ \ (si\ {{p}_{{{H}_{2(g)}}}}=1atm) \\& \oplus \ \ Couple\ \ {{O}_{2}}/{{H}_{2}}O\ :\ \ \ {{O}_{2(g)}}\ +4{{e}^{-}}+4{{H}^{+}}\leftrightarrow 2{{H}_{2}}O\ \ \ \ \ \ \ E_{{{O}_{2}}/{{H}_{2}}O}^{0}=1.229\ Volt\ \ \ \\& \ \ \ \ {{E}_{b}}=E_{{{O}_{2}}/{{H}_{2}}O}^{0}+\frac{0.059}{4}\cdot (\log {{[{{H}^{+}}]}^{4}}-\log p_{{{O}_{2(g)}}}^{1/2}) \\& \ \ \ \ {{E}_{b}}==E_{{{O}_{2}}/{{H}_{2}}O}^{0}-0.059pH\ \ (si\ \ {{p}_{{{O}_{2(g)}}}}=1atm) \\& \ \ \ \ {{E}_{b}}=1.229-0.059pH \\\end{align}$
La complexation
La formation de complexes agit sur les propriétés oxydo-réductrices. En général, il y a diminution du pouvoir oxydant en relation avec la stabilisation du complexe.
On traduit l'évolution du potentiel par un diagramme $E_{0}^{'}=f(pX)$
Complexation de Fe3+ par les ions F-
en milieu fluorure F- : $F{{e}^{3+}}+{{F}^{-}}\rightleftarrows Fe{{F}^{2+}}\ \ avec\ p{{K}_{D}}=5.2$.
On a donc les équilibres redox :
$$\begin{align}& Comme\ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ Fe{{F}^{2+}}+{{e}^{-}}\rightleftarrows F{{e}^{2+}}+{{F}^{-}} \\& Si\ \ \ \ \ \ \ \ \ \ {{c}_{F{{e}^{2+}}}}=[F{{e}^{2+}}] \\& \ \ \ \ \ \ \ \ {{c}_{F{{e}^{3+}}total}}=[F{{e}^{3+}}]+[Fe{{F}^{2+}}]=[F{{e}^{3+}}]\cdot (1+\frac{[{{F}^{-}}]}{{{K}_{D}}})\ \ \ \ \ car\ \ [Fe{{F}^{2+}}]=\frac{[F{{e}^{3+}}]\cdot [{{F}^{-}}]}{{{K}_{D}}} \\& \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ E=E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}+0.059\cdot \log \frac{[F{{e}^{3+}}]}{[F{{e}^{2+}}]}\ \ \ avec\ \ [F{{e}^{3+}}]=\frac{{{c}_{F{{e}^{3+}}total}}}{1+\frac{[{{F}^{-}}]}{{{K}_{D}}}} \\& soit\ \ \ \ \ \ \ \ \ \ \ E=E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}+0.059\cdot \log \frac{{{c}_{F{{e}^{3+}}total}}}{(1+\frac{[{{F}^{-}}]}{{{K}_{D}}})\cdot {{c}_{F{{e}^{2+}}}}} \\& \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ E=\underbrace{E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}+0.059\cdot \log \frac{1}{1+\frac{[{{F}^{-}}]}{{{K}_{D}}}}}_{E_{F{{e}^{3+}}/F{{e}^{2+}}}^{'0}}+0.059\cdot \log \frac{{{c}_{F{{e}^{3+}}total}}}{{{c}_{F{{e}^{2+}}}}} \\& \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ E=E_{F{{e}^{3+}}/F{{e}^{2+}}}^{'0}+0.059\cdot \log \frac{{{c}_{F{{e}^{3+}}total}}}{{{c}_{F{{e}^{2+}}}}} \\\end{align}$$
$\begin{align}& donc\ \ \ \ E_{Fe{{F}^{2+}}/F{{e}^{2+}}}^{'0}=0.77+0.059\cdot \log \frac{1}{1+\frac{[{{F}^{-}}]}{{{K}_{D}}}}\ \ \ \\& \oplus \ \ pour\ p{{F}^{-}}>5.2\ \ \ \ \ \ 1\ \gg \frac{[{{F}^{-}}]}{{{K}_{D}}}\ \ \ \ \ \\& \ \ \ \ E_{Fe{{F}^{2+}}/F{{e}^{2+}}}^{'0}=0.77\ Volt \\& \oplus \ \ pour\ p{{F}^{-}}<5.2\ \ \ \ \ \ 1\ll \ \ \frac{[{{F}^{-}}]}{{{K}_{D}}}\ \ \ \ \ \\& \ \ \ \ E_{Fe{{F}^{2+}}/F{{e}^{2+}}}^{'0}=0.77\ +0.059p{{F}^{-}}-0.059p{{K}_{D}}\ \ \\& \ \ \ \ et\ \ \ E_{Fe{{F}^{2+}}/F{{e}^{2+}}}^{'0}=0.463\ +0.059p{{F}^{-}}\ \ \ \\\end{align}$ $E_{Fe{{F}^{2+}}/F{{e}^{2+}}}^{'0}$ est le potentiel normal apparent pour pF-<5.2. | 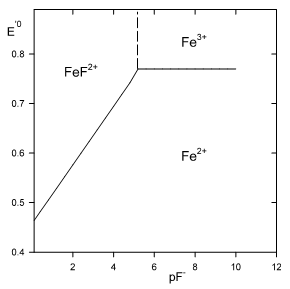 |
Cas du Cobalt +III
Le potentiel standard du couple $E_{C{{o}^{3+}}/C{{o}^{2+}}}^{0}=1.83\ Volt$ est très élevé ; en conséquence, les ions Co3+ ne sont pas stables dans l'eau : ils oxydent l'eau avec dégagement d'oxygène : $2C{{o}^{3+}}+{{H}_{2}}O\rightleftarrows 2C{{o}^{2+}}+{\scriptstyle{}^{1}/{}_{2}}{{O}_{2}}\ +2{{H}^{+}}\ $.
Cependant, dans l'exemple qui suit on pourra vérifier que la complexation des ions Co3+ provoquant une diminution du potentiel ; celui-ci n'est plus oxydant vis à vis de l'eau et les complexes du Co3+ deviennent très stables dans l'eau.
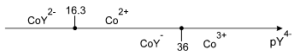
On considère le cas de Co3+ complexé par l'EDTA et on se place à $pH\ge 11$ dans le domaine de prédominance de ${{Y}^{4-}}$ .
Dans ces conditions, les espèces présentes participant aux équilibres sont :
$$\begin{align}& \ \ \ \ \ \ C{{o}^{3+}}+{{e}^{-}}\rightleftarrows C{{o}^{2+}}\ \ \ \ \ \ \ \ E_{C{{o}^{3+}}/C{{o}^{2+}}}^{0}=1.83\ Volt\ \ \ \ \ \ \ \left\{ 1 \right\} \\& \ \ \ \ C{{o}^{2+}}+{{Y}^{4-}}\rightleftarrows Co{{Y}^{2-}}\ \ \ \ \ \ \ \ \ \ p{{K}_{{{D}_{1}}}}=16.3\ \ \ \ \ \ \ \ \ \ \ \ \left\{ 2 \right\}\ \ \\& \ \ \ \ C{{o}^{3+}}+{{Y}^{4-}}\rightleftarrows Co{{Y}^{-}}\ \ \ \ \ \ \ \ \ \ \ p{{K}_{{{D}_{2}}}}=36\ \ \ \ \ \ \ \ \ \ \ \ \ \ \left\{ 3 \right\} \\& \ \ \ \ Co{{Y}^{-}}\ +{{e}^{-}}\rightleftarrows Co{{Y}^{2-}}\ \ \ \ \ \ \ \ \left\{ 4 \right\}\ \ \ \ \ Equilibre\ redox\ en\ milieu\ EDTA \\& de\ \ \left\{ 4 \right\}\ on\ \acute{e}crit:\ \ E=E_{Co{{Y}^{-}}\ /Co{{Y}^{2-}}\ }^{0}+0.059\cdot \log \frac{[Co{{Y}^{-}}]}{[Co{{Y}^{2-}}]}\equiv E_{C{{o}^{3+}}\ /C{{o}^{2+}}\ }^{0}+0.059\cdot \log \frac{[C{{o}^{3+}}]}{[C{{o}^{2+}}]} \\& si\ \ \ \ \ {{c}_{C{{o}^{3+}}\ total}}=[C{{o}^{3+}}]+[Co{{Y}^{-}}]=[C{{o}^{3+}}]\cdot (1+\frac{[Co{{Y}^{-}}]}{[C{{o}^{3+}}]})=[C{{o}^{3+}}]\cdot (1+\frac{[{{Y}^{4-}}]}{{{K}_{{{D}_{2}}}}}) \\& \ \ \ \ \ \ \ {{c}_{C{{o}^{2+}}\ total}}=[C{{o}^{2+}}]+[Co{{Y}^{2-}}]=[C{{o}^{2+}}]\cdot (1+\frac{[Co{{Y}^{2-}}]}{[C{{o}^{2+}}]})=[C{{o}^{2+}}]\cdot (1+\frac{[{{Y}^{4-}}]}{{{K}_{{{D}_{1}}}}}) \\& alors\ \ \ \ \ \ \ \ \ \ E=\underbrace{E_{C{{o}^{3+}}\ /C{{o}^{2+}}\ }^{0}+0.059\cdot \log \frac{1+\frac{[{{Y}^{4-}}]}{{{K}_{{{D}_{1}}}}}}{1+\frac{[{{Y}^{4-}}]}{{{K}_{{{D}_{2}}}}}}}_{E_{C{{o}^{3+}}total\ /C{{o}^{2+}}total}^{'0}}+0.059\cdot \log \frac{{{c}_{C{{o}^{3+}}\ total}}}{{{c}_{C{{o}^{2+}}\ total}}} \\& \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ E_{C{{o}^{3+}}total\ /C{{o}^{2+}}total}^{'0}=E_{C{{o}^{3+}}\ /C{{o}^{2+}}\ }^{0}+0.059\cdot \log (1+\frac{[{{Y}^{4-}}]}{{{K}_{{{D}_{1}}}}})-0.059\cdot \log (1+\frac{[{{Y}^{4-}}]}{{{K}_{{{D}_{2}}}}}) \\\end{align}$$
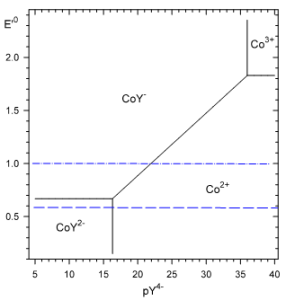
Le domaine de prédominance des complexes permet de déterminer les valeurs du potentiel normal apparent du couple $C{{o}^{3+}}/C{{o}^{2+}}$ en milieu EDTA à pH>11 : |
$\begin{align}& \oplus \ \ \ p{{Y}^{4-}}>>p{{K}_{{{D}_{1}}}}\ \ \ alors\ \ \ \ 1>>\frac{[{{Y}^{4-}}]}{{{K}_{{{D}_{1}}}}}>>\frac{[{{Y}^{4-}}]}{{{K}_{{{D}_{2}}}}}\ \\& \ \ \ \ \ E_{C{{o}^{3+}}total/C{{o}^{2+}}total}^{'0}=\ E_{C{{o}^{3+}}/C{{o}^{2+}}}^{0}=1.83\ Volt \\& \oplus \ \ \ p{{K}_{{{D}_{2}}}}<<p{{Y}^{4-}}<<p{{K}_{{{D}_{1}}}}\ \ \ \\& \ \ \ \ alors\ \ \ \ 1>>\frac{[{{Y}^{4-}}]}{{{K}_{{{D}_{1}}}}}\ mais\ \ 1<<\frac{[{{Y}^{4-}}]}{{{K}_{{{D}_{2}}}}}\ \ \\& \ \ \ E_{C{{o}^{3+}}total/C{{o}^{2+}}total}^{'0}=\ E_{C{{o}^{3+}}/C{{o}^{2+}}}^{0}-0.059p{{K}_{D2}}+0.059p{{Y}^{4-}} \\& \ \ \ E_{C{{o}^{3+}}total/C{{o}^{2+}}total}^{'0}=-0.294+0.059p{{Y}^{4-}} \\& \oplus \ \ \ p{{Y}^{4-}}<<p{{K}_{{{D}_{2}}}}\ \\& \ \ \ \ \ alors\ \ \ \ 1<<\frac{[{{Y}^{4-}}]}{{{K}_{{{D}_{2}}}}}\ \ et\ \ 1<<\frac{[{{Y}^{4-}}]}{{{K}_{{{D}_{1}}}}}\ \ \\& \ \ \ E_{C{{o}^{3+}}total/C{{o}^{2+}}total}^{'0}=\ E_{C{{o}^{3+}}/C{{o}^{2+}}}^{0}+0.059(p{{K}_{{{D}_{1}}}}-p{{K}_{{{D}_{2}}}}) \\& \ \ \ E_{C{{o}^{3+}}total/C{{o}^{2+}}total}^{'0}=0.668\ Volt \\\end{align}$ |
On peut constater qu'une faible quantité d'EDTA ( ${{10}^{-16.3}}mol.{{l}^{-1}}$) est suffisante pour faire descendre le potentiel du couple dans la zone de stabilité de l'eau :
$$\grave{a}\text{ }pH\ge 11~:\text{ }-0.9\text{ }Volt\le zone\text{ }de\text{ }stabilit\acute{e}\text{ }de\text{ }l'eau\le 1.0\text{ }Volt$$