Influence du pH sur la solubilité d'un sel peu soluble
Si les espèces résultant de la dissolution du sel peu soluble ont des propriétés acido-basiques, la solubilité dépendra du pH.
Dans le cas d'un sel ${{M}_{m}}{{A}_{n}}\rightleftarrows m{{M}^{n+}}+n{{A}^{m-}}\ ,\ si\ \ {{A}^{m-}}$ est la base conjuguée d'un acide faible, les équilibres acido basiques vont participer :
$\begin{align}& \ \ \ \ {{H}_{m}}A\rightleftarrows {{H}^{+}}+{{H}_{m-1}}{{A}^{-}}\ \ \ \ \ \ avec\ {{K}_{{{a}_{1}}}}=\frac{[{{H}^{+}}]\cdot [{{H}_{m-1}}{{A}^{-}}]}{[{{H}_{m}}A]}\ \ \ \ \ \ \ \Leftrightarrow {{K}_{{{D}_{n}}}} \\& \ {{H}_{m-1}}{{A}^{-}}\rightleftarrows {{H}^{+}}+{{H}_{m-2}}{{A}^{2-}}\ \ \ \ avec\ {{K}_{{{a}_{2}}}}=\frac{[{{H}^{+}}]\cdot [{{H}_{m-2}}{{A}^{2-}}]}{[{{H}_{m-1}}{{A}^{-}}]}\ \ \ \ \ \ \Leftrightarrow {{K}_{{{D}_{(n-1)}}}} \\& \cdot \cdot \cdot \cdot \cdot \cdot \cdot \cdot \cdot \\& H{{A}^{(m-1)-}}\rightleftarrows {{H}^{+}}+{{A}^{m-}}\ \ \ \ \ \ \ \ \ avec\ {{K}_{{{a}_{m}}}}=\frac{[{{H}^{+}}]\cdot [{{A}^{m-}}]}{[H{{A}^{(m-1)-}}]}\ \ \ \ \ \ \ \ \ \ \Leftrightarrow {{K}_{{{D}_{1}}}} \\\end{align}$
La solubilité du sel peut alors s'écrire :
$S=\frac{[{{M}^{n+}}]}{m}=\frac{\sum\limits_{i=0}^{i=m}{[{{H}_{i}}{{A}^{(m-i)-}}]}}{n}$ avec ${{K}_{s}}={{[{{M}^{n+}}]}^{m}}\cdot {{[{{A}^{m-}}]}^{n}}$$
tant que la solution est saturée.
On remarquera l'analogie avec la complexation décrite au II (la particule est ici ${{H}^{+}}$ ).
Exemple des carbonates alcalino-terreux
$MgC{{O}_{3}}$ | $CaC{{O}_{3}}$ | $SrC{{O}_{3}}$ | $BaC{{O}_{3}}$ | |
|---|---|---|---|---|
$p{{K}_{s}}$ | 5.0 | 8.32 | 10.0 | 8.30 |
Eau pure : on obtient l'expression de la solubilité en négligeant la formation du complexe $Ca{{(HCO_{3}^{-})}^{+}}$ :
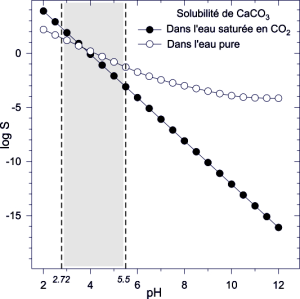
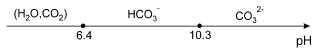
$\begin{align}& {{H}_{2}}C{{O}_{3}}\ (C{{O}_{2}},{{H}_{2}}O)\rightleftarrows {{H}^{+}}+HCO_{3}^{-}\ \ \ \ \ \ \ p{{K}_{{{a}_{1}}}}=6.4 \\& \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ HCO_{3}^{-}\rightleftarrows {{H}^{+}}+CO_{3}^{2-}\ \ \ \ \ \ \ \ \ p{{K}_{{{a}_{2}}}}=10.3 \\& S=\ \ [CO_{3}^{2-}]+\ [HCO_{3}^{-}]+[C{{O}_{2}},{{H}_{2}}O]\ \ \ \\& \log S=\frac{1}{2}(\log (1+\frac{[{{H}^{+}}]}{{{K}_{{{a}_{2}}}}}+\frac{{{[{{H}^{+}}]}^{2}}}{{{K}_{{{a}_{2}}}}\cdot {{K}_{{{a}_{1}}}}})-pK_{s}^{0})\ \ \ \\& \ \ \ \ \ \ \ \ On\ trace\ \ \ \log S=f(pH)\ pour\ C{{a}^{2+}} \\\end{align}$ Valeurs de S aux $p{{K}_{a}}$ et au pH d'une eau carbonatée normale (non saturée en $C{{O}_{2}}$ ).
|  |
$\begin{align}& (C{{O}_{2}},{{H}_{2}}O)\rightleftarrows {{H}^{+}}+HCO_{3}^{-}\ \ \ (\ [HCO_{3}^{-}]=\frac{{{K}_{{{a}_{1}}}}\cdot {{c}_{0}}}{[{{H}^{+}}]}\ )\ \\& \ HCO_{3}^{-}\rightleftarrows {{H}^{+}}+CO_{3}^{2-}\ \ \ donc\ \ \ [CO_{3}^{2-}]=\frac{{{K}_{{{a}_{2}}}}\cdot {{K}_{{{a}_{1}}}}\cdot {{c}_{0}}}{{{[{{H}^{+}}]}^{2}}} \\\end{align}$
$\begin{align}& S=\ \ [C{{a}^{2+}}]=\frac{{{[{{H}^{+}}]}^{2}}\cdot {{K}_{s}}}{{{K}_{{{a}_{2}}}}\cdot {{K}_{{{a}_{1}}}}\cdot {{c}_{0}}}\ \ \\& \log S=-2pH-p{{K}_{s}}+p{{K}_{{{a}_{2}}}}+p{{K}_{{{a}_{1}}}}-\log {{c}_{0}} \\& \log S=-2pH+7.90 \\& on\ trace\ \ \ \ \log S=f(pH) \\\end{align}$ La courbe de solubilité de $CaC{{O}_{3}}$ dans l'eau pure a été reportée avec celle obtenue en solution saturée en $C{{O}_{2}}$. |
L'eau pure carbonatée naturellement par le gaz carbonique de l'air a un $pH\approx 5.5$ , la zone grisée représente le domaine de pH des eaux qui ont dissous du $C{{O}_{2}}$ (par barbotage de gaz) ou des ions $HCO_{3}^{-}\ $ ou/et $CO_{3}^{2-}$ en traversant des sols riches en carbonates minéraux. On peut faire les remarques suivantes :
la dissolution de $C{{O}_{2}}$ dans l'eau provoque la diminution de la solubilité du calcaire (si on fait barboter du $C{{O}_{2}}$ dans une solution contenant des ions $C{{a}^{2+}}$ , on précipite $CaC{{O}_{3}}$ ).
les eaux pétrifiantes correspondent à l'intersection à pH=2.72 avec la courbe noire ; du $C{{O}_{2}}$ se dégageant (pour des raisons d'équilibre avec l'atmosphère, ou par le choc de la goutte sur le surface) la concentration en $C{{O}_{2}}$ diminue, le pH augmente, la solubilité de $CaC{{O}_{3}}$ diminue : le calcaire se dépose.
Pour dissoudre du calcaire, il faut diminuer le pH (attaque acide).