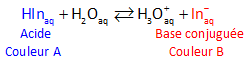
| Indicateurs
acido-basiques et titration par Wyn Locke Adaptation et mise en forme C. Jacoboni |
Les indicateurs acido-basiques (connus aussi comme les indicateurs
de pH) sont des substances qui changent de couleur avec le pH. Ce sont généralement
des acides faibles qui se dissocient légèrement dans l'eau en donnant des ions.
Un indicateur coloré peut alors être représenté comme un acide
faible HIn. On peut
représenter l'équilibre entre les 2 formes acide et base conjuguée
:
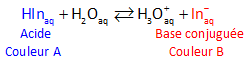
La constante d'équilibre acido-basique (Kln
constante de dissociation de l'indicateur ) s'écrit : 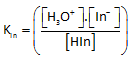
La forme acide et sa base conjuguée ont des couleurs différentes.
La solution prendra la couleur de la forme qui prédomine déterminée par le pH
de la solution.
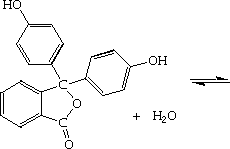
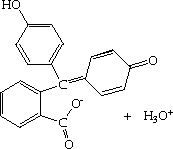
La Phénolphtaléine est un exemple d'indicateur coloré qui donne lieu à ce type d'équilibre en solution aqueuse :
| 
|
| Incolore (Acide) | Fuschia (Base) |
La Phénolphthaléine est un acide faible incolore qui se dissocie dans l'eau en formant un anion fuschia. En milieu acide, la forme dominante est la forme acide incolore, la concentration de la forme basique est trop faible pour que la couleur fuschia soit détectable. A contrario, en milieu basique, la couleur de l'anion devient bien visible.
Pour un pH voisin de la valeur du pKln , les 2 couleurs sont présentes simultanément. On considère que l'on peut distinguer ces 2 couleurs dès que la concentration de l'une des 2 formes est 10 fois supérieure à celle de l'autre. Par exemple:
On considère donc que la zone de virage (non distinction des
2 couleurs) est située dans le domaine pKln-1 < pH < pKln+1.
C'est évidemment dans ce domaine que l'indicateur coloré doit
être utilisé (on peut alors observer la disparition de la couleur de la forme
prédominante de départ ).
Le tableau qui suit donne les caractéristiques de quelques indicateurs
de pH bien connus (en cliquant sur le nom, la structure de la molécule va apparaître).
| Indicateur | Couleur | pKln | domaine de pH | |
|
Acide
|
Base
|
|||
| Bleu de Thymol - 1ère zone | rouge | jaune | 1.5 | 1.2 - 2.8 |
| Orange de Méthyle | rouge | jaune | 3.7 | 3.2 - 4.4 |
| Vert de Bromocrésol | jaune | bleu | 4.7 | 3.8 - 5.4 |
| Rouge de Méthyle | jaune | rouge | 5.1 | 4.8 - 6.0 |
| Bleu de Bromothymol | jaune | bleu | 7.0 | 6.0 - 7.6 |
| Rouge de Phénol | jaune | rouge | 7.9 | 6.8 - 8.4 |
| Bleu de Thymol - 2ème zone | jaune | bleu | 8.9 | 8.0 - 9.6 |
| Phénolphthaléine | incolore | fuschia | 9.4 | 8.2 - 10.0 |
Un indicateur de pH universel est un mélange d'indicateurs bien
choisis qui change de couleur progressivement à travers un large domaine de
pH - le pH est alors approximativement déterminé dès que quelques gouttes de
cet indicateur universel sont versées dans la solution.
Les indicateurs de pH sont utilisés dans le dosage des solutions
pour signaler la fin de la réaction de la réaction.
Refermez cette page pour revenir dans le module