12 : Synthon
pour la préparation de l'acide 12-HETE : (12.8)
- Corrigé
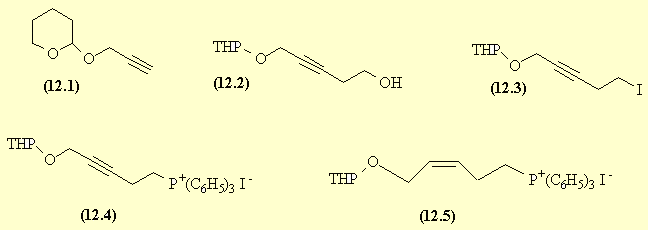

- La première étape est un blocage de la fonction alcool sous forme d'éther de tétrahydropyranyl ; c'est en fait une AdE de H+ sur la double liaison du dihydropyrane suivie de l'addition d'alcool. (Attention ! cette addition est régiosélective à cause de la présence de l'atome d'oxygène avec ses doublets non liants !!) On obtient de l'eau qui, en général, est éliminée par distillation azéotropique avec le benzène.
- Le composé acétylénique (12.1) réagit avec le lithien pour donner du butane et l'acétylure de lithium qui, étant un nucléophile, réagit sur l'oxyde d'éthylène en donnant l'alcool primaire correspondant: (12.2). Cet alcool est d'abord transformé en tosylate qui, traité par NaI, devient l'iodure (12.3) (SN).
- Avec la triphénylphosphine, on forme l'iodure de phosphonium (12.4) (SN) . Ce sel est partiellement hydrogéné et l'hydrogénation catalytique conduit au produit (12.5) de stéréochimie Z.
- Une réaction de Wittig (AdN) conduit à l'ester diénique (12.6). Le déblocage de la fonction alcool est exactement la réaction inverse du blocage en présence cette fois d'un excès d'eau.
- La fonction alcool primaire est oxydée en aldéhyde pour accéder à (12.8).