15.
Platynecine : (15.8) - Corrigé
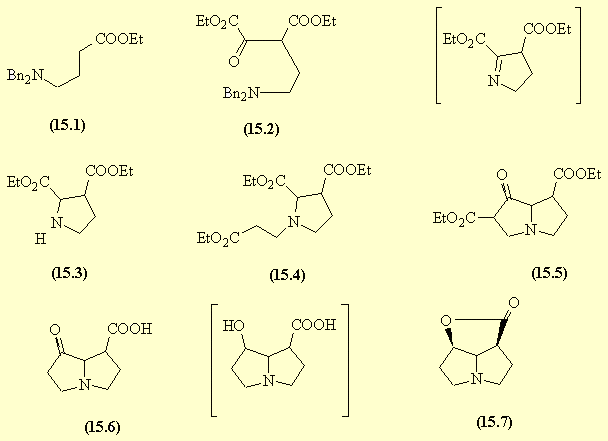
- L'alkylation de l'amine secondaire par le dérivé iodé - réaction de SN - conduit à 15.1.
- Le tertiobutylate donne le carbanion en α de la fonction ester et ce carbanion réagit en SN sur la fonction chlorure d'acide (la plus réactive) pour donner le cétodiester 15.2.
- L'hydrogénation catalytique déprotège la fonction amine qui donne une AdN interne sur le groupe carbonyle conduisant à un hémiaminal cyclique, puis à une imine qui est réduite in situ; on isole alors l'aminodiester 15.3.
- L'AdN de type Michael de cette amine sur l'acrylate d'éthyle conduit à 15.4.
- En présence d'hydrure de sodium, une cyclisation de Dieckman donne un amino cétoester cyclique 15.5.
- Une saponification, suivie d'une acidification et d'une décarboxylation conduisent à 15.6.
- La fonction carbonyle est réduite, et il se forme une lactone 15.7 par estérification interne.
- Une réduction de cette lactone conduit au produit final 15.8