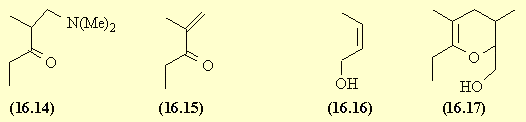| 16.
Multistriatine : (16.1) - Corrigé |
| Il
y a quatre carbones asymétriques mais deux sont en tête de pont. Donc
il y a 8 stéréoisomères ; les quatre diastéréoisomères sont représentés
; ils ont chacun un énantiomère.

|
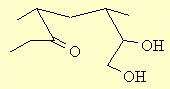
Cette molécule contient une fonction acétal.
Le précurseur pourrait être une molécule qui contient à la fois une fonction
carbonyle et un diol
 |
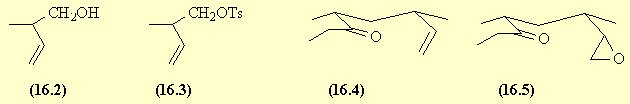
Voie 1 |
|
|
L'acide de départ est réduit en alcool
(SN sur l'acide) et l'alcool et transformé en tosylate (SN sur le
chlorure de tosyle).
En milieu basique, la 3-pentanone donne
un carbanion ; celui-ci donne une SN sur le tosylate.
La réaction d'un peracide (AdE ou oxydation)
conduit à la formation de l'époxyde.
Ce dernier en milieu acide de Lewis
fournit directement la multistriatine.
|
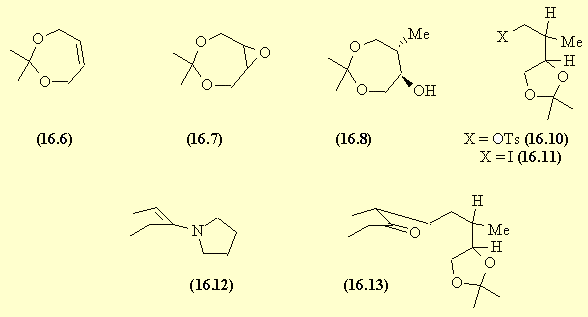
Voie 2 |
 |
|
Le diol de départ donne un acétal avec
l'acétone (AdN). La double liaison est époxydée (AdE ou oxydation).
L'ouverture stéréosélective (SN2) de
l'époxyde symétrique conduit à l'alcool .trans.
En milieu acide l'acétal s'ouvre et
donne un triol et de l'acétone (réaction inverse de l'acétalisation). Deux
fonctions alcool et l'acétone redonnent un acétal. La fonction OH
restante est transformée en tosylate (16.10).
Une SN sur ce tosylate conduit à l'iodure
(16.11).
L'ène-amine de la pentan-3-one est alkylée,
et l'hydrolyse de l'ène-amine donne la cétone (16.3) qui n'est pas
isolée.
L'ouverture de l'acétal conduit
à un diol qui en milieu acide et en présence de la fonction cétone
fournit la multistriatine par une acétalisation interne.
|
Voie 3 |
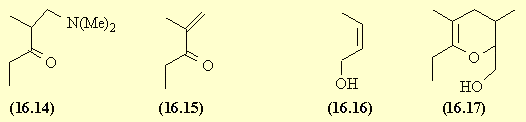 |
|
La réaction de Mannich conduit à (16.14).
Le milieu acide est ensuite neutralisé.
L'amine tertiaire est alkylée en sel d'ammonium quaternaire qui en
milieu basique subit une élimination de type E2. La triple
liaison du 2-butyn-1-ol est réduite ; en présence d'un catalyseur
" désactivé" on obtient l'alcool éthylénique (16.16).
Une réaction de Diels-Alder conduit à (16.17).
Une AdE suivie de l'addition interne
de l'alcool conduit enfin à la multistriatine.
|

|
 |
 |