5. Produits synthétisés à partir du Benzaldéhyde - Corrigé
a /
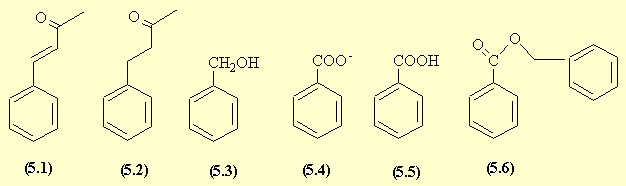
- L'aldolisation croisée (AdN) entre l'acétone qui fournit le carbanion et l'aldéhyde benzoïque, suivie d'une déshydratation donnent le produit (5.1).
-
La réduction sélective de la double liaison conduit à la benzylacétone (5.2).
-
La réaction de Cannizzaro donne accès à l'alcool benzylique (5.3) et au benzoate de sodium (5.4) qui en milieu acide est transformé en acide benzoïque (5.5).
-
La réaction de (5.3) et de (5.5) conduit au benzoate de benzyle (5.6).
-
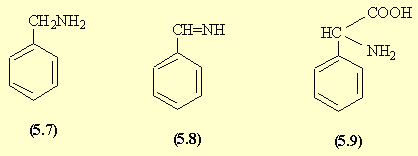
L'amination réductive du benzaldéhyde donne la benzylamine (5.7). La réaction de Strecker par l'intermédiaire de l'imine (5.8) puis de l'aminonitrile conduit à la phénylglycine (5.9).
-
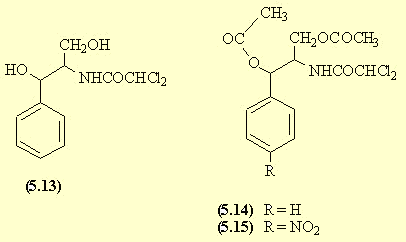
Le carbanion du nitroéthanol don ne une AdN sur le benzaldéhyde.
-
La réduction du groupe NO2 fournit l'amine (5.11). Il n'est pas possible de faire réagir un seul équivalent de chlorure d'acide sur l'amine; on fait réagir trois équivalents et on forme ainsi l'amide mais aussi les esters.
-
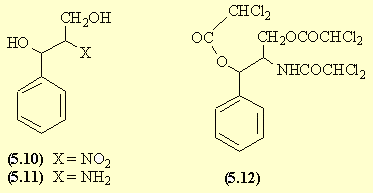
Une saponification dans des conditions douces permet la saponification des esters mais conserve la fonction amide dans la molécule (5.13). Les fonctions alcool sont protégées pour l'étape suivante par estérification sous forme d'acétate.
-
Une nitration du cycle aromatique SE est réalisée; l'isomère para (5.15) est favorisé par encombrement stérique. La saponification des esters permet de retrouver les fonctions alcool du chloramphénicol (5.16).
b )
-
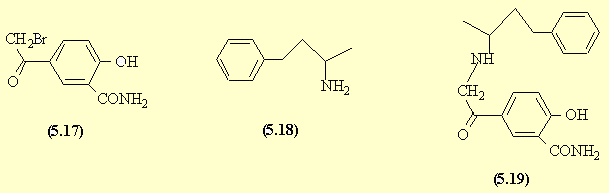
En présence d'AlCl3, on favorise la SE sur le cycle aromatique en position para pour des problèmes d'encombrement stérique. Si le bromure d'acide réagit sur le phénol, on obtient l'ester : le bromoacétate correspondant. L'amination réductive de la phénylbutanone donne l'amine correspondante (5.18). Une SN2 de l'amine déplace le brome activé par le carbonyle en α et conduit à l'aminocétone (5.19) qui est réduite en alcool : le labétalol (5.20).
c )
-
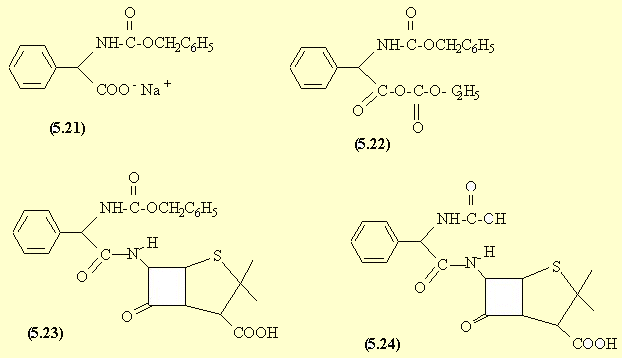
Dans la phénylglycine en milieu basique, l'amine est plus nucléophile que le carboxylate (doublet plus disponible). On forme donc, avec le chloroformiate de benzyle, la liaison de type amide en fait : un carbamate (5.21).
-
En présence de chloroformiate d'éthyle, le carboxylate réagit à son tour pour donner une liaison de type anhydride. La fonction amine du 6-APA attaque dans (5.22) le carbone le plus électrophile.
-
L'hydrogénolyse du groupe benzyle conduit à une fonction acide carbamique dans (5.24) qui perd CO2 pour donner l'amine correspondante.
-
La première réaction sert à protéger la fonction amine sous forme d'un carbamate benzylique qui permet ensuite la régénération facile et douce de l'amine.
-
La molécule (5.25) contient 5 carbones asymétriques; il existe donc 25 = 32 stéréoisomères.