- Voie 1
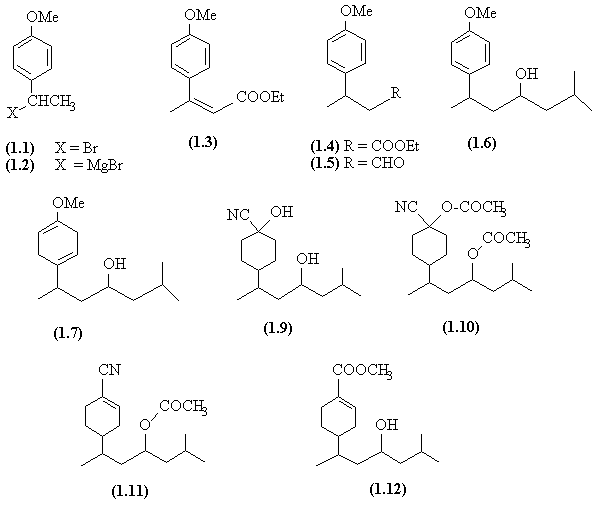
- L'éthylanisole est halogéné en position benzylique (SRad). Le dérivé halogèné obtenu (1.1) donne le réactif magnésien (1.2).
- L'addition du magnésien sur le formylformate d'éthyle (AdN) est suivie d'une déshydratation (E) de l'alcool.
- Une réduction catalytique de la double liaison conduit à (1.4). La réduction ménagée de l'ester donne l'aldéhyde (1.5) sur lequel on effectue une nouvelle addition magnésienne.
- La réduction de Birch du noyau aromatique conduit à l'hexadiène (1.7) ; on notera que la réduction est régiosélective de telle façon que le carbone qui porte un groupement donneur (OMe) n'est pas réduit.
- Une AdN sur le composé (1.8) conduit à l'hydroxynitrile (1.9). Les deux fonctions alcool sont transformées en groupes acétate.
- Une E pyrolytique est ensuite réalisée ; elle se fait préférentiellement en conjugaison avec le groupement nitrile. Le nitrile est hydrolysé en acide via l'amide et l'acétate redonne l'alcool.
- L'acide est transformé en ester de méthyle (1.12). La dernière étape est une oxydation de l'alcool à l'issue de laquelle la juvabione est isolée.
- Voie 2
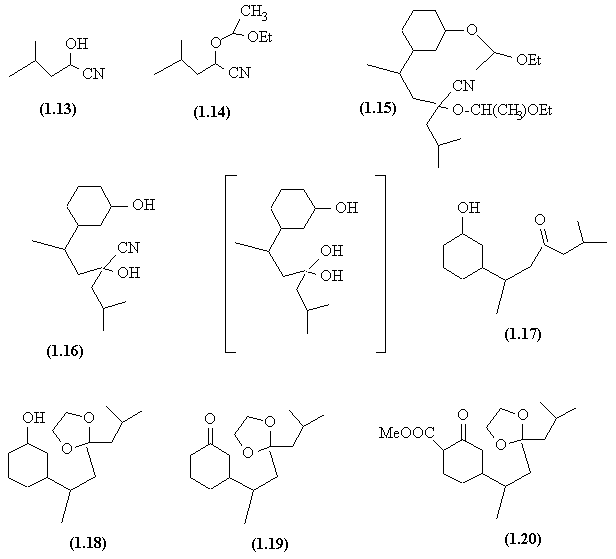
- Cette deuxième voie de synthèse débute par la formation d'un hydroxynitrile (1.13) par AdN et le blocage de la fonction alcool obtenu sous forme d'acétal (1.14) par une AdE (attention à la régiosélectivité de l'addition ! ).
- L'hydrogène en α du nitrile est acide et le carbanion obtenu en présence de diisopropylamidure de Lithium déplace le brome dans une SN.
- Les fonctions acétal sont ensuite hydrolysées. Le groupe CN- est déplacé par OH- (SN), ce qui donne un hémiacétal, en fait thermodynamiquement plus stable sous la forme carbonyle (1.17).
- Ce groupe carbonyle est protégé sous forme d'acétal (1.18) et on peut ainsi oxyder l'alcool secondaire en cétone (1.19).
- L'alkylation en α du groupe C=O (SE) conduisant à (1.20) se fait sur la position la plus éloignée de la chaine latérale.
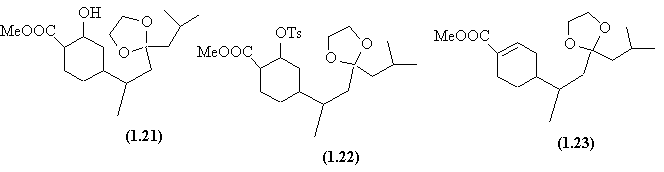
- Le groupement carbonyle est sélectivement réduit en alcool (1.21) (AdN) qui est transformé en tosylate (1.22).
- Une E2 régiosélective (orientation dûe à la conjugaison avec le groupement ester) est réalisée et une hydrolyse de l'acétal qui n'affecte pas la fonction acétate conduit à la juvabione.