| 13.
Damsin : (13.17) - Corrigé |
| |
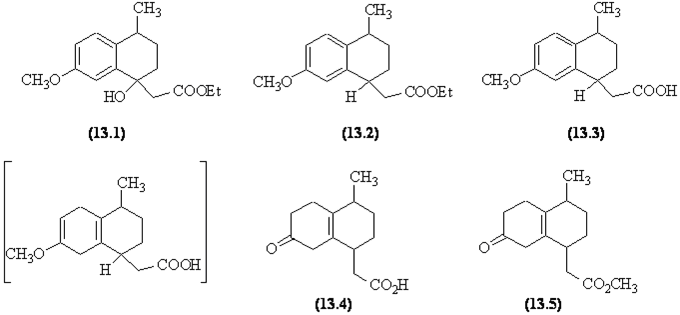
- Une réaction de Reformatsky est utilisée
pour obtenir l'hydroxyester (13.1). L'hydrogénolyse
de l'alcool est possible car c'est un alcool benzilique !
- Une saponification de l'ester conduit après
acidification à l'acide (13.3).
- Le cycle aromatique est réduit dans une
réaction de Birch en donnant un éther d'énol (notez
la régiosélectivité de cette réaction dûe
à la présence du groupe méthoxy + M) ; l'hydrolyse
de l'éther d'énol fournit la fonction carbonyle (rappelons
que l'hydrolyse de cette fonction débute par l'addition régiosélective
du proton sur la double liaison, suivie de la formation d'un hémiacétal,
et du déplacement de la réaction vers le dérivé
carbonylé).
- Une estérification par le diazométhane
donne le céto-ester (13.5)
|
|
| |
|
- L'ozonolyse conduit à une cyclodécatrione.
En milieu basique, celle-ci est alkylée sur la position située
entre deux groupes carbonyles ; mais toujours sur cette position, un
carbanion peut se former et donner une aldolisation interne. L'aldol
subit in situ une élimination en donnant la double liaison la
plus substituée (mais non conjugué !) dans le produit
(13.6).
- Les fonctions carbonyles et la fonction ester sont
réduites par LiAl H4 : (13.7). Le ?-hydroxy-acide (13.8) formé
dans l'oxydation sélective de l'alcool primaire se cyclise en
lactone (13.9). La double liaison est réduite ; la fonction alcool
restante est oxydée et le groupe carbonyle obtenu est protègé
en acétal (13.12)
- Les hydrogènes en ? de la fonction ester
sont acides et le carbanion obtenu en présence de NaH donne une
condensation de type Claisen sur le formate : (13.13). La réduction
en alcool de la fonction aldéhyde introduite, conduit à
(13.14) et le groupe carbonyle est alors déprotègé.
L'alcool est transformé en tosylate (13.16) et une élimination
E2 en milieu basique donne la molécule ciblée (13.17).
|
|
| |
|
|
 |
|