9.
Twistane : (9.17) - Corrigé

-
Une réaction de Diels Alder est la première étape de cette synthèse. Cette cycloaddition [4+2] conduit toujours majoritairement (85%) au composé endo (9.1).
-
Le diastéréoisomère exo (9.2) est présent mais, ces deux produits ne sont pas séparés. La réduction des fonctions esters donne des alcools. Ces alcools sont ensuite transformés en mésylates.
-
La SN des groupes mésyles (très bons groupes partants) par les ions CN- est facile d'autant qu'elle est menée dans la DMF (solvant polaire aprotique).
-
Les groupes nitriles sont hydrolysés en acides (9.9) et (9.10).
-
Ces acides sont d'abord traités par la soude pour passer aux carboxylates correspondants.
-
L'AdE de l'iode conduit dans une première étape aux intermédiaires pontés qui sont décrits ci-dessus.
-
Sur ces intermédiaires réactionnels, il apparait clairement que pour l'intermédiaire issu de (9.9), le carboxylate qui est très proche va pouvoir attaquer l'ion iodonium en anti conduisant à une lactone (9.11). Pour l'iodonium issu de (9.10), cette attaque n'est pas possible car le carboxylate est trop éloigné ; dans ce cas c'est un ion I- qui se fixe ( en anti également); mais les produits correspondants contenant toujours un groupement carboxylate sont solubles en phase aqueuse et sont ainsi éliminés.
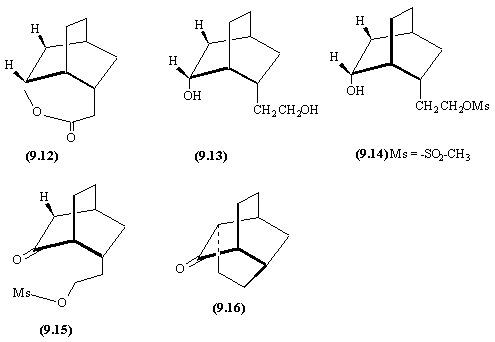
- La lactone (9.12) est réduite et on obtient un diol (9.13).
- Le groupement OH primaire le plus" dégagé " est transformé en mésylate (9.14).
- Le groupement OH secondaire est oxydé. La cétone (9.15) donne en milieu basique (NaH) le carbanion secondaire qui donne lui-même une SN interne sur le carbone qui porte le groupe mésyle.
- La réduction de Wolf-Kishner de la cétone conduit finalement au twistane.