| |
Calcul du spectre atomique d'un atome hydrogénoïde |
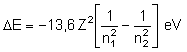
| Mode d'emploi | |
| 1 -Choisir la charge du noyau Z et la transition électronique
La longueur d'onde de la transition n2 —> n1 s'affiche ainsi que le quantum d'énergie hν correspondant. La raie émise est visualisée
si sa longueur d'onde est située dans le domaine visible |
2 - Pour la même valeur de la charge Z (même atome hydrogénoïde),calculez d'autres raies en cliquant dans l'ordre :
|
3 - Enfin, vous
pouvez visualiser pour cet atome hydrogénoïde toutes les raies calculées
(pour une valeur de Z donnée) situées dans le domaine visible
|
|
|
Pour revoir les niveaux atomiques de l'hydrogène ( Le code source Java est disponible dans le cadre de la licence GNU) |
Pour revoir toutes les séries du spectre de l'hydrogène
Mis à disposition par P. Bird |