| |
Les applications de la Diffraction des Rayons X |
On présente ici des exemples d'utilisation assez courants de la diffraction X sur poudre:
|
 |
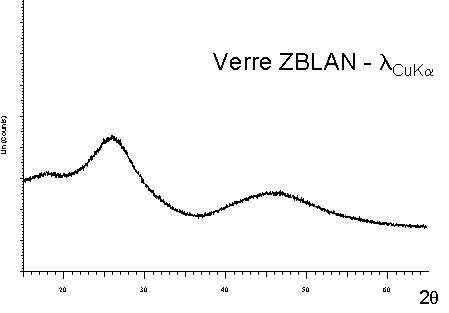
| On peut remarquer l'absence de raies discrètes
de diffraction sur le spectre du verre (en fait les larges bosses visibles
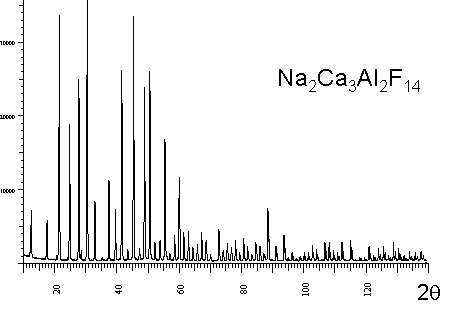
sont créées par des distributions de raies liées au désordre dans le solide). Cette dernière situation est évidemment très différente de celle rencontrées dans un solide périodique comme Na2Ca3Al2F14 dont le spectre de diffraction est particulièrement fourni en raies discrètes et fines (ce composé est d'ailleurs utilisé comme étalon en diffraction X). |
|
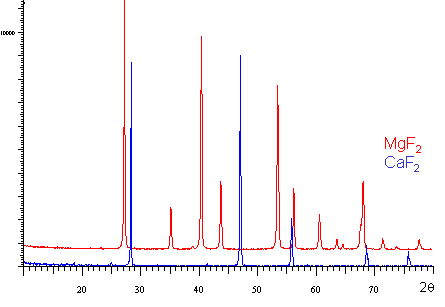
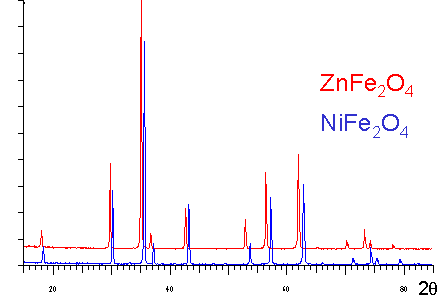
On peut constater que la distribution des raies de diffraction est différente pour les deux composés traduisant la différence de leur structure cristalline. Ces deux composés sont isoformulaires, de plus Mg et Ca sont deux éléments de la famille des alcalino-terreux. |
Mais ! CaF2 adopte la structure fluorine (CNCa2+=8). |
Modèles
JMol [Rotation: Bouton gauche et bouger] [Zoom: roulette de la souris] - [Options: Clic droit] |
| Et ! MgF2adopte la structure rutile (CNMg2+=6) |
||
| La
différence de taille des deux ions est responsable de leur différence
de comportement ( voir: Les critères géométriques) |
||
|
Modèles
JMol [Rotation: Bouton gauche et bouger] [Zoom: roulette de la souris] - [Options: Clic droit] |
 |
|
Modèles
JMol [Rotation: Bouton gauche et bouger] [Zoom: roulette de la souris] - [Options: Clic droit] |
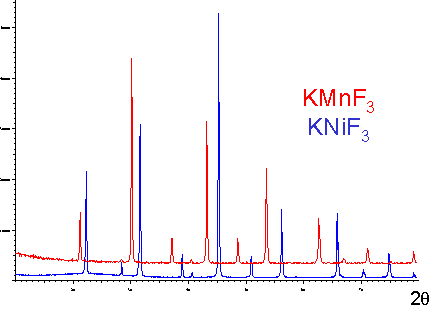 |
|
ZnFe2O4 est un spinelle direct et NiFe2O4 est un spinelle inverse |
Modèles
JMol [Rotation: Bouton gauche et bouger] [Zoom: roulette de la souris] - [Options: Clic droit] |
 |
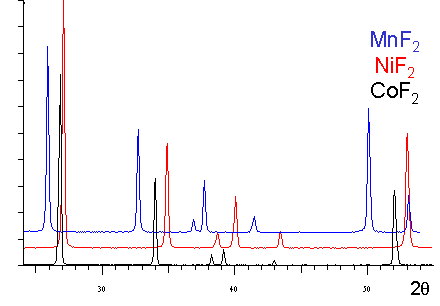
| On peut constater l'éclatement de certaines
raies dans le spectre de diffraction de NaMnF3 dû à l'abaissement
de la symétrie de la maille qui est : |
Modèles
JMol [Rotation: Bouton gauche et bouger] [Zoom: roulette de la souris] - [Options: Clic droit] KMnF3 - Cubique simple - Z=1 NaMnF3 - Orthorhombique - Z=4 |
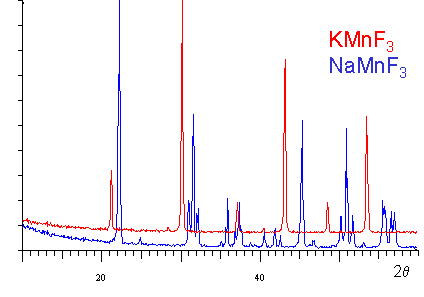
L'ion Na+ a un rayon trop faible pour stabiliser le réseau des octaèdres. La rotation concertée des octaèdres est visible sur les représentations 3D de la structure de NaMnF3 (faites tourner le modèle) |
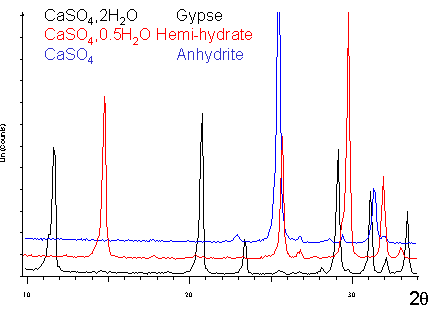
| Le plâtre
est fabriqué à partir d'une roche naturelle: le gypse (CaSO4,2H2O)
qu'on trouve en grande quantité dans le sol. La déshydratation du gypse conduit au semi-hydrate (CaSO4,0.5H2O) qui existe sous deux variétés (α et β). |
|
| La fabrication du semi-hydrate (appelé plâtre)
se fait suivant 2 méthodes: L'utilisation du plâtre se fait de la manière suivante: |
|
| Le spectre de diffraction du plâtre pris et sec est globalement identique à celui du gypse. | |
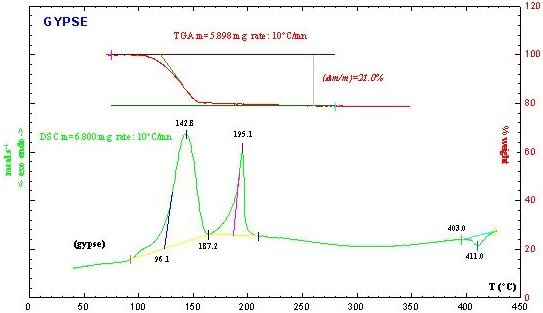
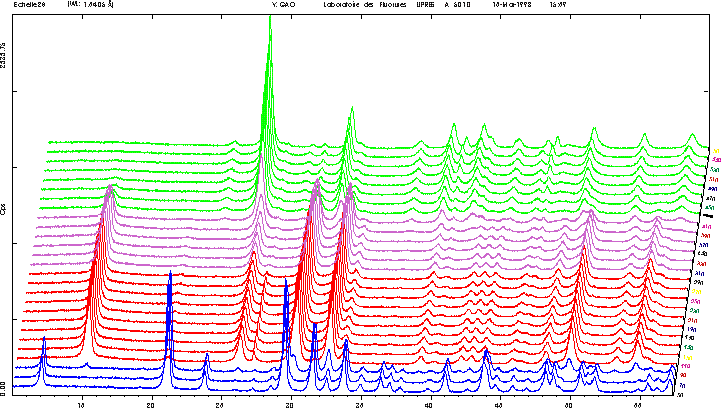
| L'examen conjoint de l'Analyse Thermique (A.T = ATG + DSC) et du thermodiffractogramme (10°C/mn) réalisés sur un échantillon de gypse permet d'interpréter les différentes étapes de la déshydratation du gypse | |
| |
 |
 |
|