Dans un gaz supposé parfait, la fraction du nombre total de molécules dont le vecteur vitesse v est un point de l'espace des vitesses d3v autour du point v est donné par la relation de Maxwell-Boltzmann
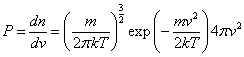
k est la constante de Boltzmann k = 1,3805.10−23 J/K, T la température absolue et m la masse d'une molécule.
Si µ est la masse molaire en g, on a m =10−3.µ.N avec N = 6.0225·1023 /mol
L'aire totale sous la courbe est égale à 1.
Cette courbe présente un maximum pour la valeur Vpp = [2.k.T / m]½qui annule la dérivée de P.
Cette valeur Vpp est la vitesse la plus probable.
La moyenne du carré de la vitesse (intégrale de v².P dv entre 0 et l'infini) vaut V2rms
= 3kT / m. Cette relation est en accord avec la définition de la température par ½.m.v² = 3/2.k.T
La vitesse moyenne (intégrale de v.P dv entre 0 et l'infini) vaut <V> = [8kT /π m]½.
