L'ion Ti (+III) solvaté
On prend comme exemple simple le processus de solvatation dans l'eau de l'ion $\text{T}{{\text{i}}^{\text{3+}}}\text{ }\!\!~\!\!\text{ (ion 3}{{\text{d}}^{\text{1}}}\text{)}$ . Les DNL des molécules d'eau sont attirés par la charge positive du cation et le complexe octaédrique $\text{Ti(}{{\text{H}}_{\text{2}}}\text{O)}_{\text{6}}^{\text{3+}}$ se forme. Sous l'action du champ électrique des ligands (champ cristallin), les niveaux d'énergie de l'ion central se trouvent modifiés. | 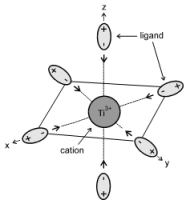 |
La forme et la symétrie du complexe décident des orbitales atomiques de l'ion qui sont concernées
(la somme des énergies des niveaux disponibles restant constante) :
| 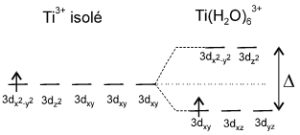 |
Les électrons périphériques de l'ion central (ici 1 e-) vont se répartir dans le nouveau schéma.
On constate un gain de stabilité (énergie plus basse de l'électron).
La couleur et le magnétisme des éléments de transition s'interprète bien dans le cadre du champ cristallin :
| 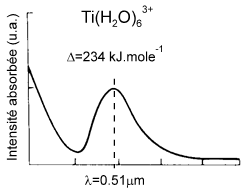 |
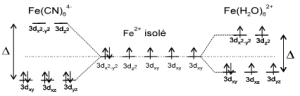
Les valeurs relatives de $\Delta $ et de l'énergie d'appariement (énergie nécessaire pour maintenir 2 électrons associés en doublet : $\text{229 }\!\!~\!\!\text{ kJ}\text{.mol}{{\text{e}}^{\text{-1}}}$ pour $\text{F}{{\text{e}}^{\text{2+}}}\text{, ion 3}{{\text{d}}^{\text{6}}}$ ) vont décider si le complexe est à :
|