Discussion sur les propriétés
Faible électronégativité : caractère électropositif donc caractère réducteur $\chi \approx 1.6$
Potentiel redox $E_{{{M}^{2+}}/M}^{0}<\text{ }0$ sauf pour $\text{C}{{\text{u}}^{\text{2+}}}\text{/Cu}$
Rayons covalents, métalliques, ioniques qui varient peu : ${{r}_{{{M}^{2+}}}}\approx 0.75\text{ }{\mathring A}$ : $\Rightarrow $ substitutions possibles des ions et des atomes (formation d'alliages).
Températures de fusion élevée (sauf Zn) >1000°C
Métaux durs et conducteurs (Cu) : plusieurs degrés d'oxydation possibles
Composés paramagnétiques, colorés $M=\sqrt{n(n+2)}$
Complexes en coordinence [6] et [4]
Les oxydes des degrés inférieurs (1 à 3) sont basiques : $MnO+{{H}_{2}}O\to Mn{{(OH)}_{2}}$
Les oxydes des degrés supérieurs (6 à 7) sont acides : $Cr{{O}_{3}}+{{H}_{2}}O\to {{H}_{2}}Cr{{O}_{4}}$
Degrés d'oxydation : les plus courants +2 et +3
Degré +1 observé pour Cu, Ag, Au
Degré 0 observé pour les métaux carbonyles ou les composés "sandwich" (dans ces composés, le métal tend à adopter la structure électronique d'un gaz rare : 18 électrons de valence)
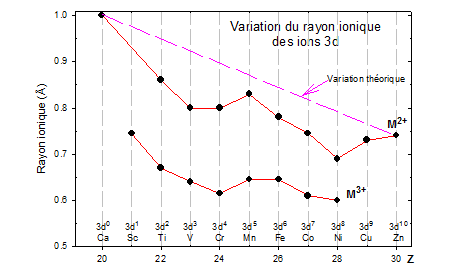
Les rayons ioniques : ils sont sensibles au champ cristallin.
Normalement Ri décroît quand Z augmente (mauvais effet d'écran des électrons ajoutés pour une même couche: c'est le cas des ions $\text{L}{{\text{n}}^{\text{3+}}}$
Pour des éléments d, les électrons des orbitales ${{\text{t}}_{\text{2g}}}$ repoussent moins les ligandes que les électrons des orbitales ${{\text{e}}_{\text{g}}}$ (qui sont dirigées vers le coordinat pour un octaèdre)
Variation en 4 temps des rayons ioniques.