Des applications de la diffraction X
On présente ici des exemples assez courants d'utilisation de la diffraction X sur poudres
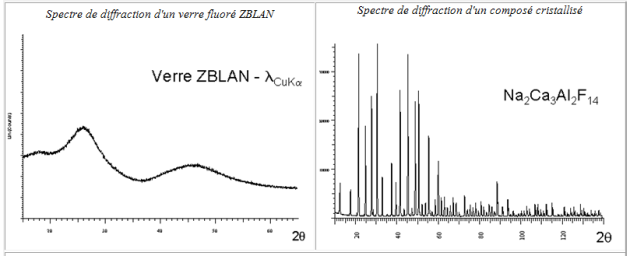
Mise en évidence du caractère cristallisé (structure périodique) ou amorphe (structure désordonnée)
On peut remarquer l'absence de raies discrètes de diffraction sur le spectre du verre (en fait les larges bosses visibles sont créées par des distributions de raies liées au désordre dans le solide).
Cette dernière situation est évidemment très différente de celle rencontrées dans un solide périodique comme $\text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{a}}_{\text{3}}}\text{A}{{\text{l}}_{\text{2}}}{{\text{F}}_{\text{14}}}$ dont le spectre de diffraction est particulièrement fourni en raies discrètes et fines (ce composé est d'ailleurs utilisé comme étalon en diffraction X).
I - Identification d'une phase cristallisée
Comparaison entre des composés isoformulaires mais de structures différentes
Spectres de diffraction de fluorures $\text{M}{{\text{F}}_{\text{2}}}$
La différence de taille des deux ions est responsable de leur différence de comportement |
Situation dans une série d'isotypes (structures-type rutile , perovskites, spinelles)
Spectres de diffraction de fluorures de structure rutile
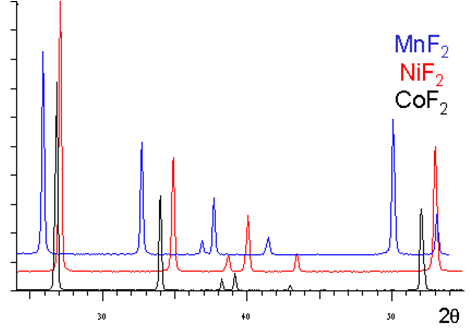
D'après la similitude de leurs spectres de diffraction, il est facile de constater que ces trois fluorures :
ont la même structure,
que leurs mailles ont des dimensions classées dans le même ordre que leur rayon ionique :
$$r\left( M{{n}^{2+}} \right)=0.80\text{ }{\mathring A},\text{ }r\left( C{{o}^{2+}} \right)=0.72\text{ }{\mathring A},\text{ }r\left( N{{i}^{2+}} \right)=0.68\text{ }{\mathring A}$$.
(plus les raies ont des valeurs de ${{\theta }_{hkl}}$ faibles plus les paramètres de maille sont grands - voir la loi de Bragg)
Spectres de diffraction de fluorures de structure perovskite ABF3
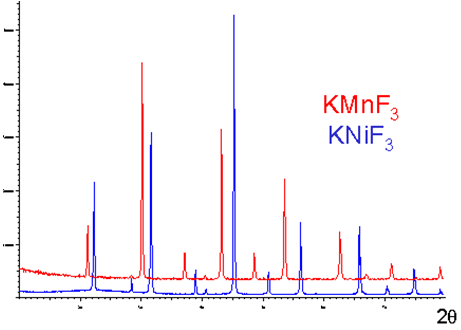
D'après la similitude de leurs spectres de diffraction, il est facile de constater que ces 2 composés:
ont la même structure,
que leurs mailles ont des dimensions classées dans le même ordre que leur rayon ionique : $$r\left( M{{n}^{2+}} \right)=0.80\text{ }{\mathring A},\text{ }r\left( N{{i}^{2+}} \right)=0.68\text{ }{\mathring A}$$.
(plus les raies ont des valeurs de ${{\theta }_{hkl}}$ faibles plus les paramètres de maille sont grands - voir la loi de Bragg)
Spectres de diffraction d'oxydes de structure spinelle $\text{A}{{\text{B}}_{\text{2}}}{{\text{X}}_{\text{4}}}$
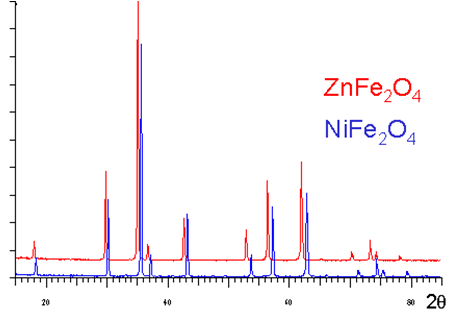
D'après la similitude de leurs spectres de diffraction, il est facile de constater que ces 2 composés ont une structure identique, même si l'occupation des sites est différentes:
sites [4] $\text{Z}{{\text{n}}^{\text{2+}}}$ dans $\text{ZnF}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{4}}}$ et la moitié de $\text{F}{{\text{e}}^{\text{3+}}}$ dans $\text{NiF}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{4}}}$ ,
sites [6] $\text{F}{{\text{e}}^{\text{3+}}}$ dans $\text{ZnF}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{4}}}$, $\text{N}{{\text{i}}^{\text{2+}}}$ et la moitié de $\text{F}{{\text{e}}^{\text{3+}}}$ dans $\text{NiF}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{4}}}$
$\text{ZnF}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{4}}}$ est un spinelle direct et $\text{NiF}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{4}}}$ est un spinelle inverse
II - Mise en évidence de distorsions cristallographiques
effets de taille des ions,
effet de la température
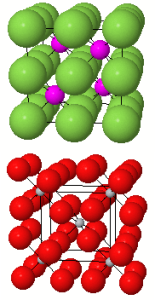
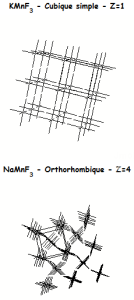
Mise en évidence d'une déformation dans la structure pérovskite
On peut constater l'éclatement de certaines raies dans le spectre de diffraction de $\text{NaMn}{{\text{F}}_{\text{3}}}$ dû à l'abaissement de la symétrie de la maille qui est :
Les relations entre les 2 mailles sont : $${{a}_{o}}\text{ }\approx \text{ }{{a}_{c}}\sqrt{2},\text{ }{{b}_{o}}\approx \text{ }2\text{ }{{a}_{c}}\text{ },~{{c}_{o}}\approx \text{ }{{a}_{c}}\sqrt{2}$$. L'ion $\text{N}{{\text{a}}^{\text{+}}}$ a un rayon trop faible pour stabiliser le réseau des octaèdres. La rotation concertée des octaèdres est visible sur les représentations 3D de la structure de $\text{NaMn}{{\text{F}}_{\text{3}}}$ |
III - Exemple de la prise du plâtre : Etude par diffraction X et analyse thermique
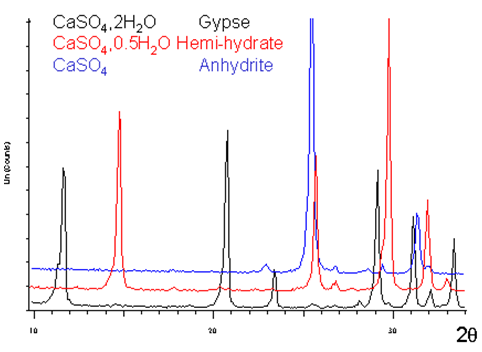
Le plâtre est fabriqué à partir d'une roche naturelle: le gypse ($\text{CaS}{{\text{O}}_{\text{4}}}\text{,2}{{\text{H}}_{\text{2}}}\text{O}$) qu'on trouve en grande quantité dans le sol.
La déshydratation du gypse conduit au semi-hydrate ($\text{CaS}{{\text{O}}_{\text{4}}}\text{,0}\text{.5}{{\text{H}}_{\text{2}}}\text{O}$) qui existe sous deux variétés ($\alpha \text{ }et\text{ }\beta $).
La fabrication du semi-hydrate (appelé plâtre) se fait suivant 2 méthodes:
Par voie sèche: le gypse est chauffé en autoclave à 150°: on obtient le plâtre industriel (semihydrate β) bien connu dans la construction.
Par voie humide, en hydratant le sulfate de calcium anhydre $\text{CaS}{{\text{O}}_{\text{4}}}$ (anhydrite) on obtient le semihydrate α (utilisé dans des cas plus particuliers).
L'utilisation du plâtre se fait de la manière suivante:
le trempage : mélange 1/1 de plâtre (semihydrate β) et d'eau
le gâchage : après quelques minutes, on obtient une pâte lisse que l'on peut utiliser (rapidement),
la prise : le plâtre durcit , il sèche en quelques heures et sa résistance mécanique provient de l'enchevêtrement des cristaux de gypse reformés dont la taille dépasse plusieurs microns.
Le spectre de diffraction du plâtre pris et sec est globalement identique à celui du gypse.
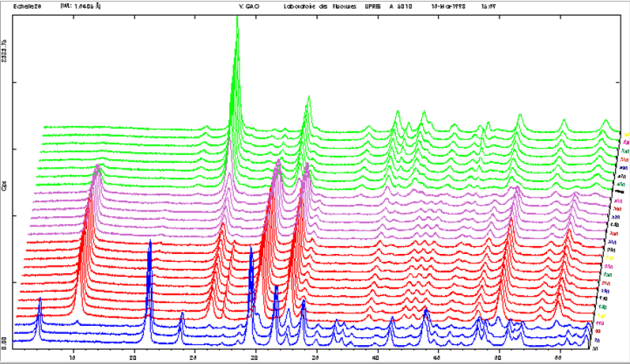
L'examen conjoint :
de l'Analyse Thermique (A.T = ATG + DSC)
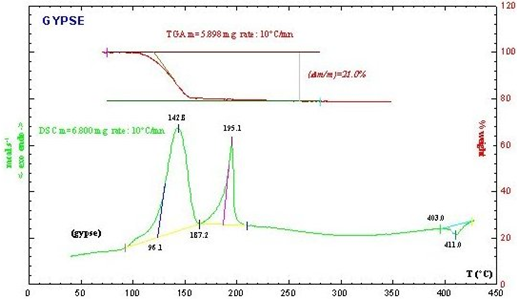
du thermodiffractogramme (10°C/mn) réalisés sur un échantillon de gypse permet d'interpréter les différentes étapes de la déshydratation du gypse.
- En bleu, le gypse $\text{CaS}{{\text{O}}_{\text{4}}}\text{,2}{{\text{H}}_{\text{2}}}\text{O}$ qui se déshydrate en semihydrate $\text{CaS}{{\text{O}}_{\text{4}}}\text{,0}\text{.5}{{\text{H}}_{\text{2}}}\text{O}$ (A.T : départ de 1,5 H2O - pic à 150°C),
- En rouge le semihydrate $\text{CaS}{{\text{O}}_{\text{4}}}\text{,0}\text{.5}{{\text{H}}_{\text{2}}}\text{O}$ (l'analyse thermique montre le départ de la demi-molécule d'eau restante - cinétique très lente comme le montre l'ATG et qui se déroule jusqu'à 290°C sur le thermodiffractogramme) et apparition de l'anhydrite III soluble $\text{CaS}{{\text{O}}_{\text{4}}}$
- En violet, l'anhydrite III soluble $\text{CaS}{{\text{O}}_{\text{4}}}$ qui montre peu de différence avec celui du semihydrate. On peut considérer que la perte de la dernière fraction d'eau altère peu la structure du semihydrate ce qui explique sans doute le fait que l'anhydrite III $\text{CaS}{{\text{O}}_{\text{4}}}$ (dit soluble) se réhydrate facilement en semihydrate $\text{CaS}{{\text{O}}_{\text{4}}}\text{,0}\text{.5}{{\text{H}}_{\text{2}}}\text{O}$,
- En vert, la variété anhydrite II (on voit le pic de transition de phase sur la DSC à 411°C). Il existe une autre variété d'anhydrite (I) obtenue par chauffage à 1200°C (en dehors de la gamme de température de cette étude)