14. Phénaglycodol : (14.5) - Correction
utilisé notamment contre l'épilepsie. Il est vendu sous la marque ACALO®.
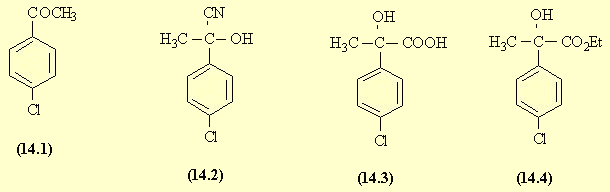
- L'acylation du chlorobenzène (SE) conduit à la p-chloroacétophénone (14.1) (séparée du dérivé ortho).
- L'addition nucléophile des ions CN- en milieu acide donne l'hydroxy-nitrile (14.2).
- Ce composé est hydrolysé en milieu acide et on obtient la fonction acide carboxylique (après passage intermédiaire par l'amide) (14.3).
- Cet acide est estérifié par l'éthanol et l'ester subit une double addition magnésienne pour conduire au glycol (14.5). La présence de la première fonction alcool ne gêne pas l'addition magnésienne à condition de prendre un excès de réactif (l'alcool est transformé en alcoolate). Il faut donc au minimum 3 équivalents de réactif magnésien.
- Cet α-glycol (14.5) en milieu acide pourrait donner une transposition pinacolique. Il parait probable que le cation benzylique se formera préférentiellement conduisant à (14.6). Si le carbocation tertiaire se forme, la migration préférentielle du groupe aryl conduira au même composé.