26. Analogue de tétracycline : (26.4) - Corrigé
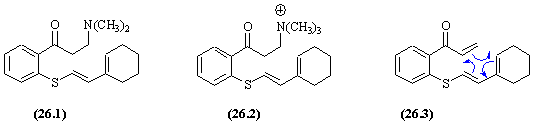
- La base de Schiff (26.1) est formée dans une réaction de Mannich. Cette base est alkylée (SN) pour conduire au sel d'ammonium quaternaire non isolé.
- Ce dernier subit une réaction l'élimination mais le diène (26.3) n'est pas non plus isolé car il donne in situ une cyclodaddition [4+2] ou réaction de Diels Alder conduisant à une cyclisation.
- L'alkylation et l'élimination, l'élimination et la réaction de Diels Alder qui s'enchainent sans qu'il y ait à isoler le produit intermédiaire, constituent des "tandems réactionnels".
- Il existe dans la littérature beaucoup d'autres exemples de tandems réactionnels très utilisés en synthèse organique.
- La réaction de Diels-Alder conserve la stéréochimie du diène et celle du diénophile. Donc les deux hydrogènes des extrémités du diène (en bleu sur le produit final) se retrouvent en position cis. L'hydrogène en α du groupe C=O peut etre soit en cis , soit en trans par rapport au deux autres (formation des liaisons de part et d'autre du plan du diène)