27. Aristolactame : (27.3) - Corrigé
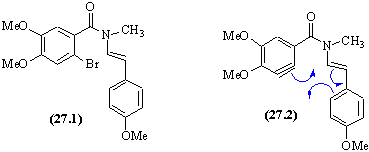
- La première réaction de cette synthèse est une SE sur le noyau aromatique le plus activé.
- La régiosélectivité de cette réaction est intéressante. Les positions ortho des groupes OMe sont soit occupées soit encombrées ; une position para est occupée : la SE se fait majoritairement sur l'autre position para libre.
- En milieu très basique , il se produit une élimination conduisant à un aryne. Cette espèce très réactive donne la molécule (27.3) par une cycloaddition [4+2] = une réaction de Diels-Alder interne. La molécule obtenue, perd très facilement de l'hydrogène pour donner un squelette aromatique de phénantrène ; c'est le produit déshydrogèné qui est l'aristolactame.