13.
Cristaux liquides : (13.8) - Corrigé
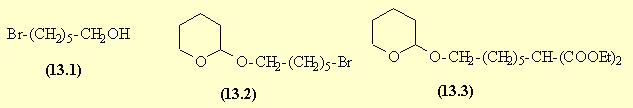
-
La réduction de l'acide bromo-hexanoïque donne l'alcool primaire (13.1). La fonction alcool est alors protégée sous forme d'éther de tétrahydropyranyl : composé (13.2) (cf. exercice 12).
-
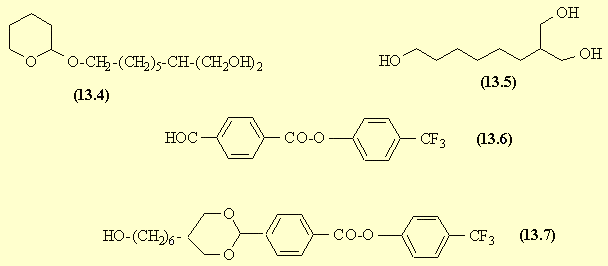
Le carbanion issu du malonate de diéthyle réagit en SN avec (13.2), le groupe partant étant l'ion bromure. Les fonctions ester introduites sont réduites en fonctions alcool : (13.4). La fonction alcool est déprotégée, conduisant à un triol (13.5): le mécanisme est exactement l'inverse de celui de la protection.
-
Le produit (13.6) résulte de la réaction d'estérification entre l'acide et le phénol. Le triol (13.5) qui possède deux fonctions alcool suffisamment proches donne en milieu acide l'acétal de l'aldéhyde soit (13.7).
-
La fonction alcool qui est restée libre, donne avec le chlorure d'acryloyle l'ester correspondant (13.8).
-
Par polymérisation radicalaire, le monomère (13.8) conduit à un polymère à propriétés cristaux liquides.
-
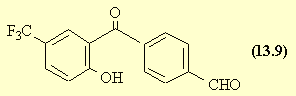
Si, dans la sixième étape on avait utilisé un chlorure d'acide au lieu de l'acide lui-même, on aurait pu avoir compétitivement à l'estérification une acylation du noyau aromatique du phénol (noyau "activé") conduisant à (13.9)