3. Phéromone : (3.5) - Corrigé
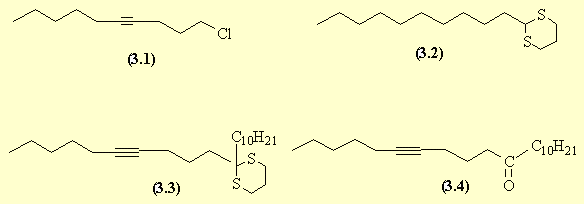
- La première réaction est une SN de l'acétylure de sodium sur un dérivé halogéné : le brome est un meilleur groupe partant que le chlore. La deuxième réaction est la formation du dithioacétal cyclique (3.2) : un dithiane (réaction analogue à la formation des acétals). L'hydrogène porté par le carbone situé entre les deux atomes de soufre est faiblement acide et, en présence d'une base très forte, on obtient le carbanion correspondant. Ce carbanion est lui-même un nucléophile qui réagit avec le dérivé chloré selon une réaction de SN pour donner (3.3).La déprotection conduit à la cétone (3.4).
- L'ensemble de cette séquence est une illustration du concept de "groupe masqué" : le carbone de l'aldéhyde qui a toujours un caractère positif, a été transformé " momentanément" en carbone négatif dans le dithiane : il y a eu" inversion de polarité" pour pouvoir réagir sur le carbone électrophile du dérivé halogéné.
- La réduction partielle de la double liaison (catalyseur " empoisonné") conduit à la phéromone (3.5) de stéréochimie Z par la réduction catalytique.

- Le produit (3.6) est la forme "ouverte" du 5-hydroxypentanal (en équilibre avec l'hémiacétal interne). Mais comme seule la forme aldéhyde réagit dans la réaction suivante, l'équilibre se déplace vers l'aldéhyde. Une réaction de Wittig (AdN) permet d'obtenir le composé (3.7). (Dans ces conditions opératoires le stéréoisomère Z est obtenu). Cet alcool primaire est oxydé en aldéhyde (3.8). Une AdN d'un magnésien, suivie d'une oxydation de l'alcool obtenu, conduit à la phéromone (3.5).
- Au lieu d'utiliser le sel de phosphonium pour la réaction de Wittig, il serait possible d'utiliser le phosphonate : (EtO)2PO-CH2CH2CH2CH3 qui serait obtenu par réaction du phosphite de triéthyle (EtO)3P sur le dérivé halogéné correspondant; c'est la réaction de Wittig-Horner. Le sous produit phosphoré est un phosphate (EtO)2PO2-, soluble en phase aqueuse, donc plus facile à éliminer que l'oxyde de triphénylphosphine.
- Les réactifs magnésiens peuvent dans certaines conditions donner deux réactions parasites : - une énolisation si le composé carbonylé possède un hydrogène en position α :
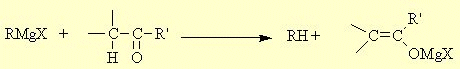
- après hydrolyse le composé carbonylé est récupèré sans "apparemment" avoir réagit. - une réduction si le réactif de Grignard contient un hydrogène en position β
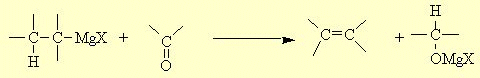
- dans ce cas le composé carbonylé est simplement réduit et donne l'alcool après hydrolyse