4.
Alphaprodine : (4.6) - Corrigé

- L'addition de Michael de la méthylamine sur le méthacrylate de méthyle conduit à l'aminoester (4.1). Une seconde addition de Michael de ce composé sur l'acrylate donne l'aminodiester (4.2). En milieu basique, ce diester produit le cétoester (4.3) selon une condensation de Dieckmann, par passage par l'énolate thermodynamique. Ce dernier est soumis à une hydrolyse suivie d'une décarboxylation pour donner (4.4). La réaction avec le bromure de phénylmagnésium donne l'alcool tertiaire correspondant (4.5) qui est ensuite acylé par l'anhydride propionique pour obtenir le produit final.
-
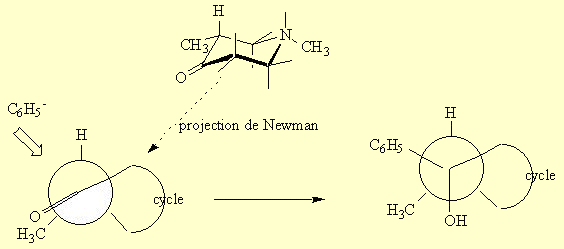
L'entrée du groupe phényle se fera du côté du plan du groupe carbonyle le moins encombré. C'est à dire que le groupe phényle se placera préférentiellement en position équatoriale soit en trans par rapport au groupe CH3.