3.
Caténane : (3.14) - Corrigé
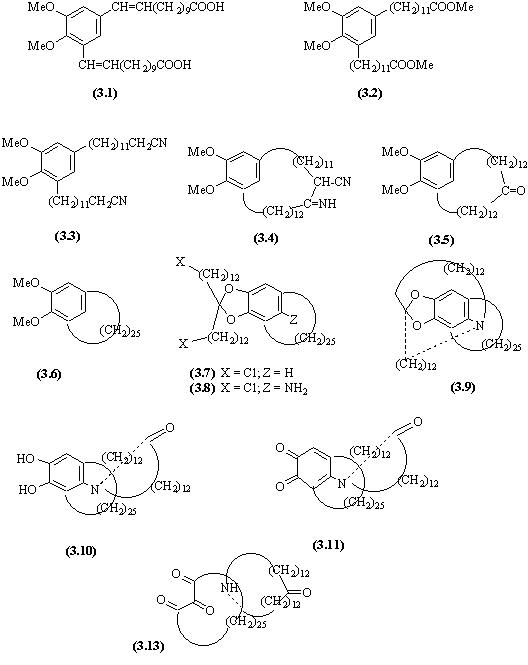
- Une double réaction de Wittig permet l'introduction des deux chaines latérales dans lesquelles les fonctions esters sont saponifiées.
- Les doubles liaisons sont réduites et les esters de méthyle sont reformés avec le diazométhane : composé (3.2).
- La réduction des esters par les ions H-, conduit aux alcools qui traités par PBr3 conduisent aux bromures (SNi), qui traités par les ions CN- (SN) conduisent aux nitriles (3.3).
- En milieu basique, la condensation de Thorpe-Ziegler (mécanisme identique à celui de la réaction de Dieckmann) conduit au produit (3.4).
- Celui-ci, après hydrolyse et décarboxylation donne une cétone cyclique (3.5).
- Cette cétone est réduite selon la réaction de Wolff-Kishner. Les fonctions éthers sont débloquées par une réaction de SN avec HBr en donnant le diphénol.
- A partir de ce phénol, un acétal est préparé (3.7) et le groupe NH2 est introduit sur le cycle aromatique.
- Une réaction de SN permet de remplacer les atomes de chlore par des atomes d'iode (meilleurs groupes partants) et spontanément dans une double SN interne l'amine déplace les atomes d'iode en formant un cycle qui est imbriqué dans le cycle précédent. La réaction compétitive qui donnerait un cycle non imbriqué est stériquement défavorisée.
- L'hydrolyse de l'acétal donne la molécule (3.10) formée des deux cycles imbriqués dont l'un contient une fonction cétone et l'autre les phénols.
- Ces phénols sont oxydés en quinones (3.11) et en deux étapes on parvient au composé (3.12) dans lequel l'azote est " détaché" du cycle aromatique.
- Une ozonolyse coupe les doubles liaisons de la quinone et enfin une réduction de Wolff-Kishner des quatre fonctions carbonyles conduit au caténane (3.14).