4. Acide lysergique : (4.10) - Corrigé
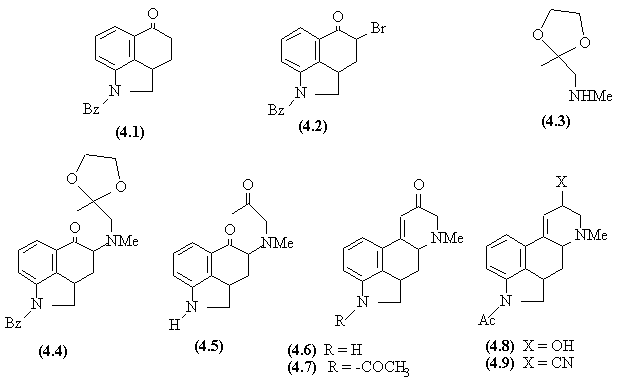
- La fonction acide est transformée en chlorure d'acyle et une acylation de Friedel-Crafts (SE interne) ferme un troisième cycle.
- Une monohalogénation en α du C=O est réalisée (4.2).
- Un blocage du carbonyle sous forme d'acétal est
effectué sur l'aminocétone.
L'amine secondaire déplace le brome dans une SN puis l'acétal est hydrolysé. Mais, dans cette opération la fonction benzylamide est également hydrolysée en amine. - L'aminodicétone (4.5) donne en milieu basique une aldolisation interne suivie d'une E facilitée par la conjugaison.
- La fonction amine secondaire est protégée à nouveau, sous forme d'acétamide (4.7).
- Le groupe carbonyle est réduit en alcool (4.8), qui est transformé par une SNi en chlorure qui est lui-même transformé par une SN en nitrile (4.9).
- L'hydrolyse du nitrile et de l'amide donne l'acide et une déshydrogénation sélective conduit finalement à l'acide lysergique (4.10).