5.
Prostaglandines : (5.10)- Corrigé
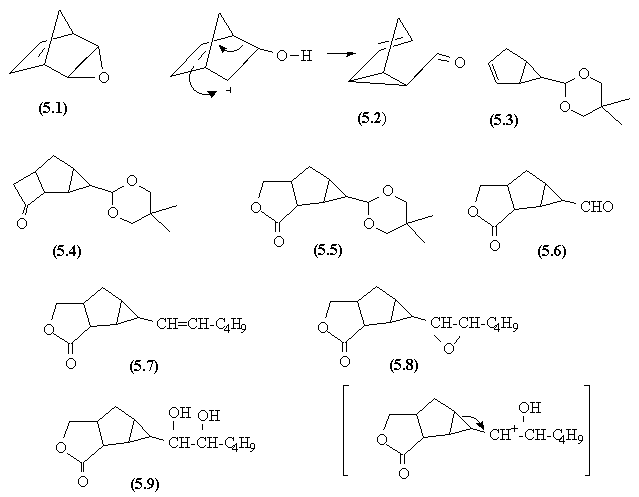
- Le norbornadiène est époxydé sur une seule double liaison. L'ouverture de cet époxyde en milieu acide provoque un réarrangement du squelette carboné qui donne l'aldéhyde (5.2).
- Le groupe aldéhyde est protégé sous forme d'acétal (5.3).
- Une addition photochimique [2 +2] avec le cétène permet la formation d'un cyclobutane et on obtient (5.4).
- La cyclobutanone subit un réarrangement de Baeyer-Villiger conduisant à une lactone dans (5.5).
- L'hydrolyse de l'acétal régénère la fonction aldéhyde.
- La réaction de Witig conduit au composé (5.7) dont la double liaison est époxydée (5.8).
- L'ouverture de l'époxyde en milieu acide donne le glycol (5.9).
- En milieu acide, la formation d'un carbocation suivie de l'ouverture du cyclopropane permettent d'obtenir le produit (5.10). La formation du carbocation à partir de l'autre fonction alcool ne permet pas l'ouverture du cyclopropane et est moins favorable.