| 8.
Caryophyllène : (8.12) - Corrigé |
| |
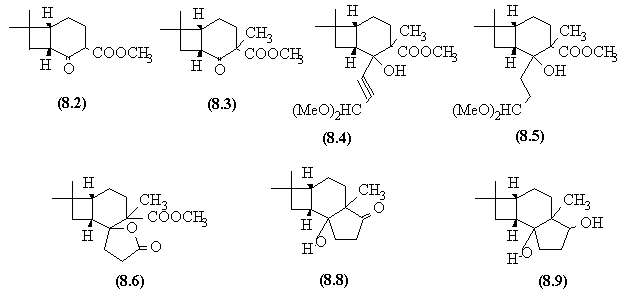
- La première réaction de cette synthèse
est une addition photochimique [2 +2] qui conduit à un composé
dans lequel les jonctions sont cis.
- Le carbanion secondaire donne une SN sur le carbonate
de diméthyle donnant (8.2).
- Un carbanion délocalisé sur la fonction
cétone et sur la fonction ester est formé, ce qui permet
l'alkylation de la cétone par l'iodure de méthyle (8.3).
- L'organolithien s'additionne sur la cétone (plus
réactive que l'ester) (8.4) et la triple liaison est hydrogénée
(8.5).
- L'acétal est hydrolysé et conduit à
un aldéhyde qui est oxydé en acide.
- Mais le produit (8.6) est en fait la lactone qui se
forme par une estérification interne.
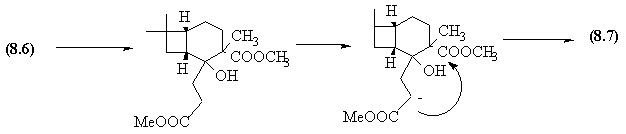
- Après ouverture de la lactone par MeO-
, le diester obtenu donne une condensation de Dieckmann selon le mécanisme
décrit ci-dessous.
|
 |
- La saponification suivie d'une hydrolyse acide et d'une
décarboxylation conduisent au produit (8.8).
- La réduction du carbonyle donne l'alcool (en
fait un diol) (8.9).
- L'alcool secondaire est transformé en tosylate
qui en présence du carbanion du DMSO, donne une fragmentation
décrite ci-dessous pour conduire à (8.10).>
|
 |
- Le passage par l'énolate permet l'inversion de
configuration entre les composés (8.10) et (8.11).
- Une réaction de Wittig termine la synthèse
du caryophyllène (8.12).
|
| |
 |
|
 |
|