| |
Les diagrammes de phases |
I – Notion de phases.
C’est l’état
sous lequel on trouvera un constituant A ou un mélange de constituants
A+B. Pour définir une phase, il faut s’assurer que le système
est bien homogène (même composition chimique et mêmes propriétés
en tout point).
II – Variables d’un système.
Ce sont
des variables intensives.
|
Chaleur
|
T (température) | si T = Cste : Diagramme isotherme |
|
Travail
|
P (pression du système) | si P = Cste : Diagramme isobare |
III – Variance
d’un système.
La variance d'un système est le nombre
de facteurs que l'on peut faire varier indépendamment les uns des autres
sans provoquer la rupture de l'équilibre.
Soit un système formé de f phases
(a, b, d, e) . Dans la phase a
il y a i constituants et nia est
le nombre de moles du constituant i dans la phase a.
La fraction molaire du constituant i dans la phase a
est définie par 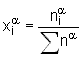 .
.
Pour toutes les phases, on peut écrire : 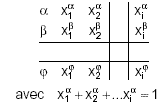
On obtient alors l'expression de la variance d'un système: v = n+2- φ (Règle des phases de GIBBS)
| Glace —› Eau | n=2-1=1; φ=2
donc v = n+2- φ=1+2-2=1
|
| H2O —› H2 +1/2 O2 (à 2000°C) |
|
| Fe3O4 + 4CO —› 3FeO + 4 CO2 |
il faut fixer T et P pour définir l'équilibre. |
La courbe de liquidus est la courbe au-dessus de laquelle
n’existe que du liquide.
La courbe de solidus est la courbe au-dessous de laquelle n’existe
que du solide.
| Exemples | |
| liquide —› solide (1) + solide (2) | c'est le cas de l'eutectique |
| solide (3) —› solide (1) + solide (2) | c'est le cas de l'eutectoïde |
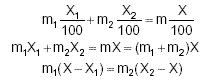 Alors : m1.NM = m2.NP |
 |
|
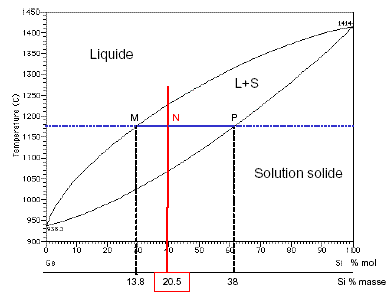
Exemple
: A 1180°C, 100g d’un mélange
de Ge-Si à 20,5% en masse de silicium est constitué du mélange
d’un solide et d’un liquide tel que :
 |
|
V – Les différents types de diagrammes liquide-solide.
Les points singuliers les plus importants sont les points eutectiques (mélange eutectique), points péritectiques et les points correspondant aux compositions définies:
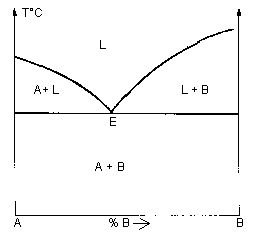
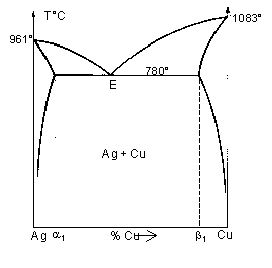
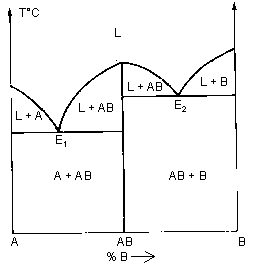
| Eutectique (v=0 ) en E: liquide « solide (A) + solide (B) | |
 |
 > > |
| Eutectique simple | Eutectique avec solution solide partielle |
| Péritectique (v=0 ) en P: solide AB —› liquide (L) + solide (B) |
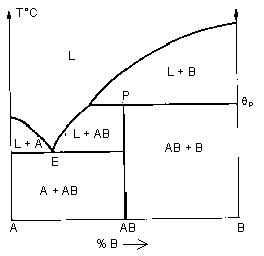 |
| Composé défini | |
 |
 |
| Fusion congruente: AB(solide) —› AB (liq) | Fusion non congruente: AB(solide) —› B(solide) + liquide |
VI – Equilibres liquide-vapeur :
| A fuseau continu |
A azéotrope | |
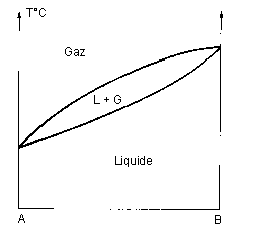 |
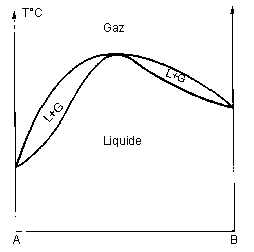 Alcool-eau azéotrope à maximum 78°C (98% alcool) |
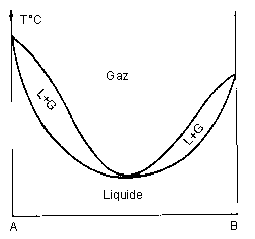 Acetone -eau azéotrope à minimum 28°C |
VIII – Etude et caractérisation des diagrammes de phases solide-liquide.
Analyse thermique simple : très simple d'emploi, sur 20g de matière; suivi des courbes de refroidissement en fonction du temps. La longueur des paliers (isotherme) permet de tracer la courbe de Tamman pour préciser les points singuliers.
Analyse thermique différentielle (ATD) : plus sophistiquée,
sur 10 à 500mg de matière; suivi du comportement thermique en
comparaison avec un échantillon témoin (étalon), possibilité
d'accéder aux chaleurs de transformation et de détecter les
transitions de phases. Le témoin type est la silice qui possède
une transition de phase bien visible à 573°C (![]() ).
).