| |
Le critère géométrique |
Le tableau I rappelle la limite théorique déduite des rayons utiles
des sites [4], [6] et [8] formés dans les empilements compacts et semi-compacts.
|
Valeur limite |
|
|
|
On rappelle que les anions sont en général
plus gros que les cations de numéro atomique Z voisin; l'arrangement va
dépendre essentiellement de l'espèce la plus grosse (qui va créer
les sites). Le type structural adopté par les composés ioniques
sera donc déterminé par le rapport entre les rayons des espèces
en présence (rayon du cation/ rayon de l’anion - critère
géométrique) fixant ainsi la coordinence du cation.
I - Les structures de type AX
λLe tableau II rassemble les données géométriques
des ions participant aux structures ioniques de type AX ainsi que la valeur
du rapport rayon du cation/ rayon de l’anion pour la structure
type choisie pour représenter ce type de coordinence.
|
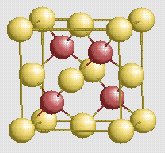
ZnS [4] blende |
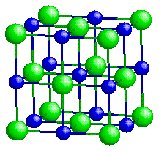
NaCl [6] |
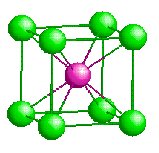
CsCl [8] |
|
|
|
0.25 |
0.52 |
0.93 |
 |
 |
 |
Le type structural adopté par les composés ioniques de type AX
(quel que soit X= O2-, S2-, F-., N3-...
et A un métal dont le degré d’oxydation conduit au motif formulaire
AX ) sera déterminé par ce rapport (critère géométrique)
fixant ainsi la coordinence du cation.
Le cas des halogénures alcalins est décrit dans le tableau III
à gauche (les types structuraux NaCl et CsCl sont zonés plus foncé)
et le tableau de droite donne des exemples d’oxydes et sulfures.
|
Li |
Na |
K |
Rb |
Cs |
Type structural |
C.N. |
M |
|||
|
F |
0.44 |
0.70 |
0.98 |
1.09 |
1.23 |
MO |
NaCl |
6 |
Mg, Ca, Ba, Cd, Ti, Zr, Fe, Co, Ni |
|
|
Cl |
0.33 |
0.52 |
0.73 |
0.82 |
0.93 |
ZnS Wurtzite |
4 |
Be, Zn |
||
|
Br |
0.31 |
0.49 |
0.68 |
0.76 |
0.87 |
MS |
NaCl |
6 |
Mg, Ca, Sr, Ba, Cd, Ti, Zr, Mn, Pb, Ln, U |
|
|
I |
0.28 |
0.44 |
0.62 |
0.69 |
0.78 |
ZnS Blende |
4 |
Be, Zn, Cd, Hg |
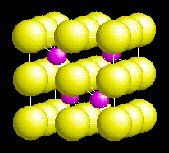
II - Les structures
de type AX2
Le même critère géométrique va évidemment
s'appliquer aux composés de type AX2. La seule différence
se trouve dans le fait qu'il y a 2 fois plus d'anions que de cations (sauf pour
la structure anti-fluorine type Cu2O – situation inverse).
Le tableau IV rassemble les données géométriques des ions
participant aux structures ioniques de type AX2 ainsi que la valeur
du rapport (rayon du cation/ rayon de l’anion) pour la structure-type
choisie pour représenter ce type de coordinence.
|
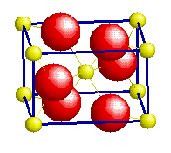
SiO2 [4] |
TiO2 [6] |
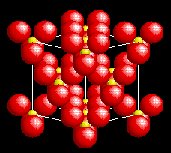
CaF2 [8] |
|
|
|
0.25 |
0.52 |
0.93 |
 |
 |
 |
Le facteur de tolérance de Goldschmidt t
rend compte de l'influence des rayons ioniques sur la structure cristalline
adoptée par les composés du type ABX3.
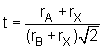
|
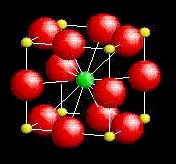 |
| Le tableau suivant donne des exemples
des variantes structurales adoptées suivant la valeur du facteur
de tolérance t (la valeur t=1 correspond au cas idéal où les ions A et X, B et X sont respectivement tangents entre eux): |
|
|
Valeurs de t |
Symétrie |
Structure type |
|
0.85...0.87 |
Quadratique |
KCdF3 |
|
0.88....1.0 |
Cubique |
KNiF3 |
| 1.00....1.06 |
Hexagonale |
BaTiO3 |