Datation au carbone 14
Loi de décroissante radioactive
Tous les processus nucléaires ont une cinétique du premier ordre. Le taux de transformation d'un nucléide radioactif par unité de temps est proportionnel au nombre de nucléides présents :
$\frac{dN}{dt}=-\lambda N$ avec $\lambda $ constante radioactive,
Après intégration, on a obtient la loi de décroissante radioactive : $N={{N}_{o}}{{e}^{-\lambda t}}$, N0 est le nombre de nucléides au temps t = 0
On définit la période T ou temps de 1/2 vie d'un nucléide radioactif comme étant le temps nécessaire à la transformation de la moitié de No initial :
$$T=\frac{\ln 2}{\lambda }$$
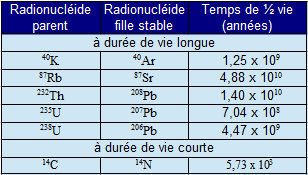
Le tableau ci-contre donne les périodes de quelques radionucléides utilisés pour les datations. Les isotopes à durée de vie longue sont utilisés en géologie pour la datation des roches. Compte tenu de la faible période du $^{14}C$ (5730 ans), la datation est très efficace pour dater des objets vieux d'un peu moins de 30 000 ans.
Principe de la datation
Le $^{\text{14}}\text{C}$ radioactif est produit de manière continue dans l'atmosphère par l'action des neutrons des rayons cosmiques sur l'azote $^{\text{14}}\text{N}$ de l'atmosphère suivant la réaction :
$${}_{7}^{14}N\,+\,{}_{0}^{1}n\to \,{}_{6}^{14}C+{}_{1}^{1}H$$
Cet isotope s'incorpore dans les molécules de $\text{C}{{\text{O}}_{\text{2}}}$ puis dans les tissus des plantes par photosynthèse. La concentration dans les plantes vivantes (et dans les animaux qui les mangent) est maintenue constante de par l'équilibre avec l'atmosphère ; le nombre de désintégration par unité de temps et de masse est également contant pour tous les organismes vivants (15,3 désintégration par minute et par gramme de carbone total noté $dpm\text{.}{{g}^{-1}}$ ). Quand la plante meurt, la concentration en $^{14}C$ décroît à cause de la désintégration :
$${}_{6}^{14}C\to {}_{7}^{14}N\,+\,{}_{-1}^{0}{{e}^{-}}+\gamma $$
On mesure dans l'échantillon que l'on veut dater soit la proportion de carbone 14 par rapport au carbone total (isotope $^{\text{12}}\text{C}$ et $^{\text{13}}\text{C}$ ) à l'aide d'un spectromètre de masse soit le nombre v de désintégration par unité de temps et de masse (exprimé en dpm) qui est proportionnel au nombre de nucléide N. Avec la loi de décroissance on en déduit l'âge de l'échantillon.
$$v(t)=v(t=0)\,{{e}^{-\lambda t}}$$
Exemple : datation du site mégalithique de Stonehenge.
On a prélevé des échantillons de charbon de bois provenant de mines à Stonehenge. Le taux de désintégration obtenu est de $9,65\text{ }dpm\text{.}{{g}^{-1}}$
l'âge de ces échantillons est : $t=-\frac{T}{\ln 2}\times \ln \left[ \frac{v(t)}{v(t=0} \right]=-\frac{5730}{0,693}\times \ln \left[ \frac{9,65}{15,3} \right]=3810\,\,ann\acute{e}es$




