Les liaisons d'interaction électrostatique
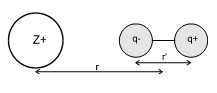
Elles caractérisent des interactions liées à l'existence d'un moment dipolaire dans une molécule (polaire) ; le dipôle peut être schématisé par un système de 2 charges opposées (${{\text{q}}^{\text{ }\!\!\pm\!\!\text{ }}}$) distantes de $r$ , le moment dipolaire est alors $\mu =qr'$.
On peut citer 2 types d'interaction :
|  |
|  |
C'est le cas de $\text{N}{{\text{O}}_{\text{2}}}$ (il faut noter la présence d'un électron célibataire) qui existe sous la forme d'un dimère incolore ${{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}}$ (la proportion $\text{N}{{\text{O}}_{\text{2}}}\text{/ }{{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}}$ dépend de la température : 0% de $\text{N}{{\text{O}}_{\text{2}}}$ à 0°C, 100% à 150°C). | 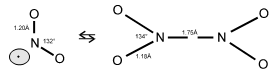 |




