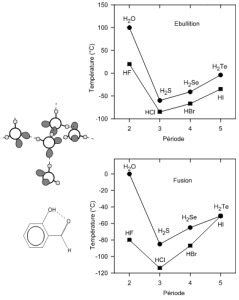
La liaison “ Hydrogène
Cette liaison se manifeste à chaque fois que des ligands de forte électronégativité sont associés à l'hydrogène. On prendra l'eau comme exemple : la molécule d'eau a une géométrie tétraèdrique provoquée par la présence de 2 liaisons $\text{ }\!\!\sigma\!\!\text{ (O-H)}$ et 2 DNL (voir VSEPR). Les valeurs d'électronégativité (ENO=3.5 et ENH=2.1) expliquent que le doublet de liaison $\text{ }\!\!\sigma\!\!\text{ }$ va être attiré par l'atome d'oxygène faisant alors apparaître une charge partielle positive (${{\text{ }\!\!\delta\!\!\text{ }}^{\text{+}}}$) sur l'hydrogène (lié au déficit électronique partiel). Les atomes d'hydrogène seront alors attirés par les DNL des autres molécules d'eau. En moyenne, chaque molécule ${{\text{H}}_{\text{2}}}\text{O}$ possède 2 DNL et $\text{2H }{{\text{ }\!\!\delta\!\!\text{ }}^{\text{+}}}$) ce qui conduit à une réticulation (association) de chaque molécule ${{\text{H}}_{\text{2}}}\text{O}$ à 4 autres molécules d'eau. La mobilité moléculaire diminue : les températures de changement d'état (fusion et ébullition) augmentent. Les liaisons hydrogène peuvent être intermoléculaires (exemple précédent) ou intramoléculaires comme dans les nitrophénols ou les aldéhydes hydroxyaromatiques ; elles sont très fréquentes dans les dérivés organiques. |