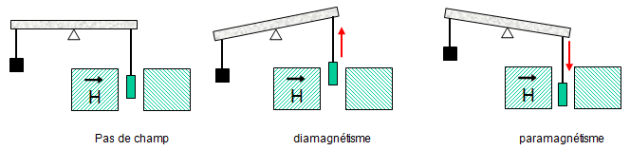
Rappel
Propriétés magnétiques :
- Un composé est paramagnétique s'il possède des électrons dont les spins ne sont pas appariés c'est à dire des électrons célibataires ; il est attiré par un champ magnétique.
- Un composé est diamagnétique si tous ses électrons sont appariés ; il est repoussé par un champ magnétique.
Le moment magnétique M, qui est un moment induit, est la résultante du moment de spin ($\overrightarrow{\mu }{{}_{S}}$) et du moment orbital (${{\vec{\mu}}_{L}}$). Pour un élément de transition engagé dans un complexe , le moment orbital ${{\vec{\mu}}_{L}}$ est le plus souvent nul (parce que bloqué) : M ne dépend donc que du moment de spin ${{\vec{\mu}}_{S}}$. Le moment magnétique s'exprime par le nombre effectif de magnétons de Bohr (neff) donné par :
ou encore
magnéton de Bohr : moment magnétique associé à une mole d'électrons : $$1{{\mu }_{B}}=N.\beta =N\frac{he}{4\pi mc}$$ | 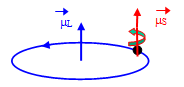 |
Moment magnétique des éléments de transition
Des théories capables de décrire les liaisons dans les composés de coordination, de rationaliser et de prédire leurs propriétés ont été formulées :
La théorie de la liaison de valence (1930)
La théorie du champ cristallin puis la théorie du champ des ligands (1950-1960)
La théorie des orbitales moléculaires





