Théorie du champ cristallin
Ce modèle est fondé sur une interaction purement électrostatique entre le métal central et les ligands, c'est à dire une interaction ionique (atome central à charge positive $\Leftrightarrow $ ligand avec doublet libre à charge négative).
Champ cristallin octaédrique
Dans l'atome isolé, les niveaux d'énergie des cinq orbitales 3d sont dégénérés (même énergie). Sous l'effet d'un champ électrique sphérique, les orbitales sont déstabilisées d'une quantité $\text{ }\!\!\Delta\!\!\text{ E}$ . Maintenant, si le cation (atome central) est placé au centre d'un environnement octaédrique, les six ligands vont créer un champ électrostatique dont l'influence sur les 5 orbitales d du cation dépendra de l'orientation de celles-ci. Les cinq orbitales d ne sont donc plus équivalentes vis-à-vis des six ligands : il y a levée de dégénérescence . Les orbitales ${{\text{d}}_{\text{xy}}}\text{, }{{\text{d}}_{\text{yz}}}\text{, }{{\text{d}}_{\text{xz}}}$ sont stabilisées, elles pointent entre les ligands. Un électron occupant une de ces orbitales subit une répulsion moindre par les ligands donc l'énergie de ces orbitales est abaissée . Elles sont appelées ${{\text{t}}_{\text{2g}}}$ . |  |
Les orbitales ${{\text{d}}_{{{\text{x}}^{\text{2}}}-{{\text{y}}^{\text{2}}}}}\text{, }{{\text{d}}_{{{\text{z}}^{\text{2}}}}}$ sont déstabilisées, elles sont dirigées directement vers les ligands. Un électron occupant une de ces orbitales subit une répulsion plus forte des ligands donc l'énergie de ces orbitales est augmentée. Elles sont appelées ${{\text{e}}_{\text{g}}}$ .
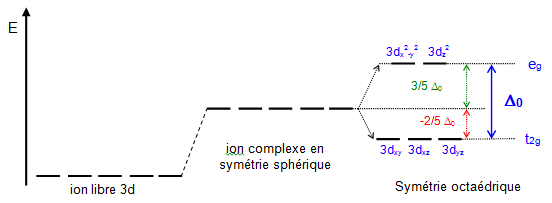
${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{O}}}$ représente l'éclatement du champ cristallin octaédrique qui, en terme d'énergie, exprime la séparation des niveaux ${{\text{t}}_{\text{2g}}}$ et ${{\text{e}}_{\text{g}}}$.
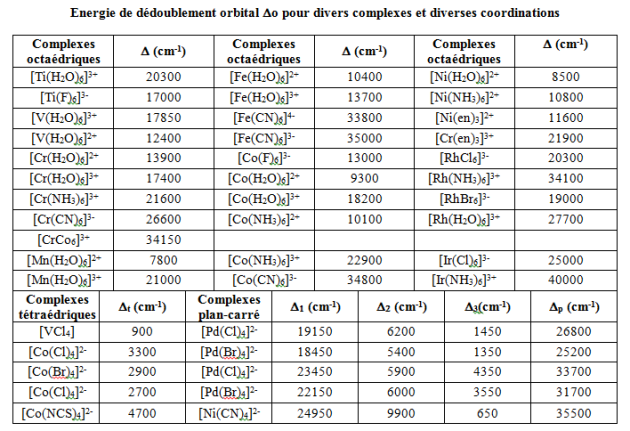
Exemples de complexes – calculs de l'énergie de stabilisation du champ cristallin ESCC[6]
Pour une configuration générale ${{t}_{2g}}^{x}{{e}_{g}}^{y}~$ : ${{\text{E}}_{\text{SCC }\!\![\!\!\text{ 6 }\!\!]\!\!\text{ }}}\text{= x (-2/5 }{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{o}}}\text{) + y (3/5 }{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{o}}}\text{)}$
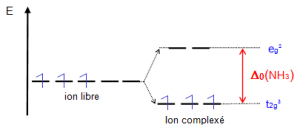
Sous l'effet du champ octaédrique des ligands ${{\text{H}}_{\text{2}}}\text{O}$ , les électrons tendent à occuper les niveaux les plus bas en respectant la règle de Hund (multiplicité maximale c'est à dire le maximum d'électrons non appariés). L'énergie gagnée après formation du complexe est : ${{\text{E}}_{\text{SCC}}}\text{= 3(-2/5 }{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{o}}}\text{) = -6/5 }{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{o}}}\text{=-1}\text{.2 }{{\Delta }_{o}}$ $~~{{\Delta }_{o}}=\text{ }21600\text{ }c{{m}^{-1}}$ pour 6 ligands ${{\text{H}}_{\text{2}}}\text{O}$ |
$M{{n}^{3+}}~:\text{ }ion\text{ }{{d}^{4}}$
Au delà de 3 électrons d, deux possibilités se présentent :
- soit l'électron occupe le niveau d'énergie élevée ${{\text{e}}_{\text{g}}}$
- soit l'électron s'apparie avec un électron de l'une des orbitales ${{\text{t}}_{\text{2g}}}$.
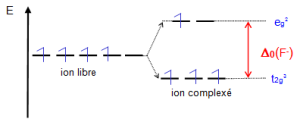
Configuration 1 : ${{\left[ Mn{{F}_{6}} \right]}^{3-}}-\text{ }ion\text{ }M{{n}^{3+}}~:\text{ }{{d}^{4}}$
Sous l'effet du champ octaédrique faible des ligands ${{\text{F}}^{\text{-}}}$ , une levée de dégénérescence des niveaux est observée. Le remplissage électronique se fait en respectant le règle de Hund. ${{\text{E}}_{\text{SCC}}}\text{= 3(-2/5 }\text{ }\!\!\Delta\!\!\text{ }{{\text{ }}_{\text{o}}}\text{) + 1(3/5 }\text{ }\!\!\Delta\!\!\text{ }{{\text{ }}_{\text{o}}}\text{) = -3/5 }\text{ }\!\!\Delta\!\!\text{ }{{\text{ }}_{\text{o}}}\text{= -0}\text{.6 }\text{ }\!\!\Delta\!\!\text{ }{{\text{ }}_{\text{o}}}$ ${{n}_{eff}}=\text{ }4.95$ soit 4 électrons célibataires |
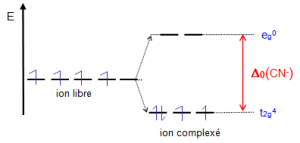
Configuration 2 : ${{\left[ Mn{{\left( CN \right)}_{6}} \right]}^{3-}}-\text{ }ion\text{ }M{{n}^{3+}}~:\text{ }{{d}^{4}}$
Sous l'effet du champ octaédrique fort des ligands $\text{C}{{\text{N}}^{\text{-}}}$ , la règle de Hund n'est plus suivie et les électrons s'apparient dans les orbitales ${{\text{t}}_{\text{2g}}}$ avant de remplir les orbitales ${{\text{e}}_{\text{g}}}$. Ce mode de remplissage est observé quand l'énergie nécessaire pour apparier 2 électrons (P) dans une orbitale est inférieure à ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{o}}}$ . Il y a alors modification des propriétés magnétiques : ${{n}_{eff}}=\text{ }2.92$ soit 2 électrons célibataires ${{\text{E}}_{\text{SCC}}}\text{= 4(-2/5 }{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{o}}}\text{) + 1P = -8/5 }{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{o}}}\text{+ P = -1}\text{.6 }{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{o}}}\text{+ P}$ |
La configuration adoptée par le complexe est celle qui possède l'énergie la plus basse, cela dépendra des importances relatives de ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{o}}}$ et P.
Exemple : $\text{F}{{\text{e}}^{\text{2+}}}\text{- ion }{{\text{d}}^{\text{6}}}$
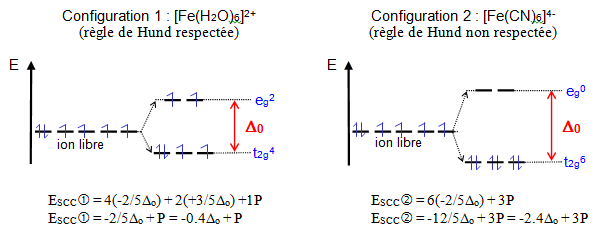
Pour observer la configuration 1, il faut : ESCC(1) < ESCC(2) soit $0.4{{\Delta }_{o}}+\text{ }P\text{ }<-2.4{{\Delta }_{o}}+\text{ }3P$ ou encore ${{\Delta }_{o}}<\text{ }P$ . La configuration adoptée dépend donc de l'importance relative de ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{o}}}$ et de P :
Si ${{\Delta }_{o}}<\text{ }P$, on observe la configuration 1 et on parle de configuration spin élevé et de champ faible
Si ${{\Delta }_{o}}>\text{ }P$, on observe la configuration 2 et on parle de configuration spin faible et de champ fort
Pour $F{{e}^{2+}}\to P\text{ }=\text{ }19200\text{ }c{{m}^{-1}}\text{ }et\text{ }{{\Delta }_{o}}=\text{ }33800\text{ }c{{m}^{-1}}\text{ }pour\text{ }{{\left[ Fe{{\left( CN \right)}_{6}} \right]}^{4-}}$ .
On a ${{\Delta }_{o}}>\text{ }P\to {{\left[ Fe{{\left( CN \right)}_{6}} \right]}^{4-}}$ : complexe à champ fort
Pour $F{{e}^{2+}}\to P\text{ }=\text{ }19200\text{ }c{{m}^{-1}}\text{ }et\text{ }{{\Delta }_{o}}=\text{ }10400\text{ }c{{m}^{-1}}\text{ }pour\text{ }{{\left[ Fe{{\left( {{H}_{2}}O \right)}_{6}} \right]}^{2+}}$ .
On a ${{\Delta }_{o}}<\text{ }P\to {{\left[ Fe{{\left( {{H}_{2}}O \right)}_{6}} \right]}^{2+}}$ : complexe à champ faible
${{\left[ Fe{{\left( CN \right)}_{6}} \right]}^{4-}}$ aura la configuration ${{t}_{2g}}^{6}{{e}_{g}}^{0}$ . Il ne possède pas d'électron célibataire et est diamagnétique.
${{\left[ Fe{{\left( {{H}_{2}}O \right)}_{6}} \right]}^{2+}}$ aura la configuration ${{t}_{2g}}^{4}{{e}_{g}}^{2}$ . Il possède 4 électrons célibataires et est paramagnétique.
Les valeurs de ${{\Delta }_{o}}$ sont accessibles par l'expérience alors que les énergies d'appariement P sont obtenues par le calcul pour l'ion libre.
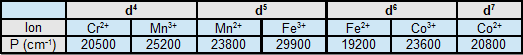
Energies d'appariement pour l'ion libre (* Pour l'ion complexé, les valeurs de P sont inférieures de 15 à 30%)
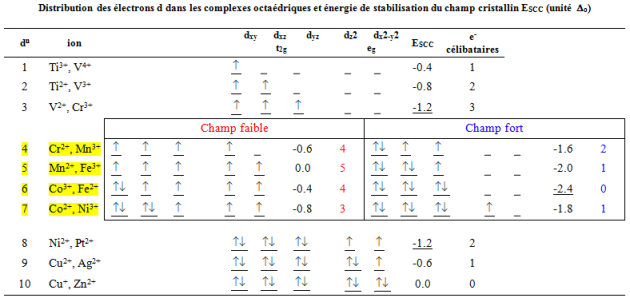
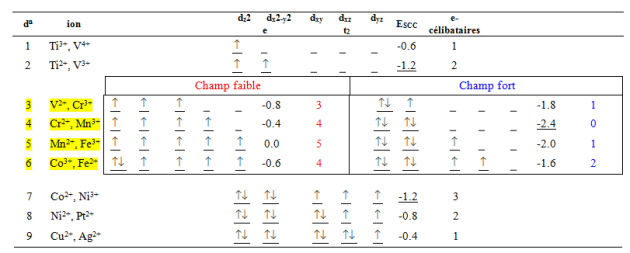
Les différentes configurations possibles des électrons d dans les complexes octaédriques ainsi que leur énergie de stabilisation du champ cristallin sont rassemblées dans le tableau suivant. Les éléments les plus stabilisés en coordinence octaédrique sont les éléments ${{d}^{3}}\text{ }et\text{ }{{d}^{8}}$ (${{E}_{SCC}}=-1.2{{\Delta }_{o}}$ ). L'élément ${{d}^{6}}$ présentera facilement une configuration spin faible (donc diamagnétique) dans un champ des ligands fort (${{E}_{SCC}}=-2.4{{\Delta }_{o}}$ ).
Distribution des électrons d dans les complexes octaédriques et énergie de stabilisation du champ cristallin ESCC (unité ${{\Delta }_{o}}$)
Champ cristallin tétraédrique
Dans la coordination tétraédrique, les niveaux d'énergie des orbitales d éclatent à nouveau en 2 niveaux d'énergie $e$ et ${{t}_{2}}$. Cette coordination est liée de près à la géométrie cubique qui constitue ainsi un point de départ commode pour obtenir le diagramme de dédoublement des orbitales par le champ cristallin pour le complexe $\text{M}{{\text{L}}_{\text{4}}}$ .
Dans la disposition tétraédrique (on enlève un ligand sur deux des sommets du cube), les ligands ne s'approchent directement d'aucune des orbitales d du métal, mais ils viennent plus près des orbitales dirigées vers le milieu des arêtes du cube (${{\text{d}}_{\text{xy}}}\text{, }{{\text{d}}_{\text{yz}}}\text{ et }{{\text{d}}_{\text{xz}}}$ ) que celles qui sont dirigées vers le centre des faces (${{\text{d}}_{{{\text{z}}^{\text{2}}}}}\text{ et }{{\text{d}}_{{{\text{x}}^{\text{2}}}-{{\text{y}}^{\text{2}}}}}$).
Les orbitales déstabilisées sont donc ${{\text{d}}_{\text{xy}}}\text{, }{{\text{d}}_{\text{yz}}}\text{ et }{{\text{d}}_{\text{xz}}}$ et les orbitales stabilisées sont ${{\text{d}}_{{{\text{z}}^{\text{2}}}}}\text{ et }{{\text{d}}_{{{\text{x}}^{\text{2}}}-{{\text{y}}^{\text{2}}}}}$, appelées orbitales $e$.
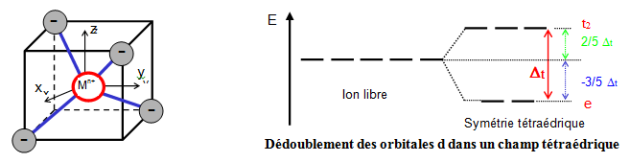
Le dédoublement ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{t}}}$ dû au champ cristallin tétraédrique est intrinsèquement plus faible que celui du champ octaédrique, parce qu'il n'y a que deux-tiers des ligands et que leur effet sur les orbitales d est moins direct. On montre que ${{\Delta }_{\mathbf{t}}}\cong \mathbf{4}/\mathbf{9}{{\Delta }_{\mathbf{o}}}$ (4 ligands en champ tétraédrique / 6 ligands en champ octaédrique). Il en résulte que les énergies de dédoublement des orbitales des complexes tétraédriques ne sont en général pas assez élevées pour forcer les électrons à s'apparier, et de ce fait les configurations à spin faible sont rarement observées.
Le passage d'une configuration spin élevé à spin faible est possible pour les éléments ${{\text{d}}^{\text{3}}}$ à ${{\text{d}}^{\text{6}}}$ , mais peu d'exemples de complexes présentent cette possibilité.
Exemple de complexes – calculs de l'énergie de stabilisation du champ cristallin ESCC[4] :
Pour une configuration générale : $[{{\text{E}}_{\text{SCC }\!\![\!\!\text{ 4 }\!\!]\!\!\text{ }}}\text{= x (-3/5}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{t}}}\text{) + y (2/5}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{t}}}\text{)}$
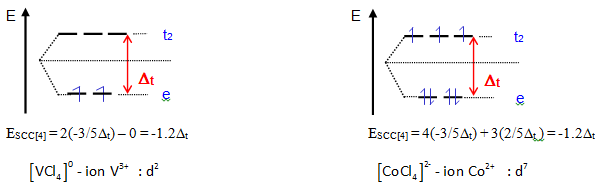
Distribution des électrons d dans les complexes tétraédriques et énergie de stabilisation du champ cristallin ESCC (unité ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{t}}}$)
Le tableau précédent rassemble les différentes configurations électroniques pour un champ des ligands tétraédriques.
Les éléments les plus stabilisés en coordinence tétraédrique sont les éléments ${{\text{d}}^{\text{7}}}$ et ${{\text{d}}^{\text{2}}}$ (${{\text{E}}_{\text{SCC}}}\text{=-1}\text{.2}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{t}}}$ ).
L'ion ${{\text{d}}^{\text{4}}}$ sera le mieux placé pour une configuration spin faible (${{E}_{SCC}}=-2.4{{\Delta }_{t}}$).
Champ cristallin plan-carré
La configuration plan-carré est rencontrée essentiellement pour les éléments ${{\text{d}}^{\text{8}}}$ ($\text{N}{{\text{i}}^{\text{2+}}}\text{,P}{{\text{d}}^{\text{2+}}}\text{,P}{{\text{t}}^{\text{2+}}}$ . Elle est obtenue à partir d'un complexe octaédrique en éloignant à l'infini les ligands placés selon l'axe Oz. Dans ces conditions, les orbitales dirigées suivant x et y se trouvent déstabilisées alors que les orbitales présentant une orientation selon z se trouvent stabilisées.
Le passage de la géométrie octaédrique à la géométrie plan-carré passe par la déformation de l'octaèdre (effet Jahn-Teller : rencontré pour les ions ${{\text{d}}^{\text{9}}}$ ($\text{C}{{\text{u}}^{\text{2+}}}$ ) et ${{\text{d}}^{\text{4}}}$ ($\text{C}{{\text{r}}^{\text{2+}}}\text{ ou M}{{\text{n}}^{\text{3+}}}$ ) et provoque une nouvelle levée de dégénérescence des orbitales d, conduisant à quatre niveaux d'énergie, comme le montre le schéma ci-dessous.
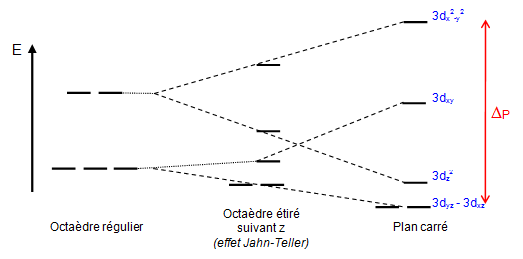
Exemple de complexes pour des ions ${{d}^{8~}}$ :
La figure ci- dessous représente l'éclatement des niveaux d'énergie dans le cas d'un champ faible et d'un champ fort (complexe ${{\left[ \text{Ni}{{\left( \text{CN} \right)}_{\text{4}}} \right]}^{\text{2-}}}$ ).
Dans le cas d'un champ fort (ligands $\text{C}{{\text{N}}^{\text{-}}}$), les électrons vont occuper les niveaux d'énergie les plus bas car ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{1}}}$ est grand ; le complexe est alors diamagnétique.
En principe, il est possible d'obtenir des complexes à spin élevé (champ faible) si l'énergie d'appariement P est supérieure à ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{1}}}$ mais aucun exemple de complexe ne semble connu.
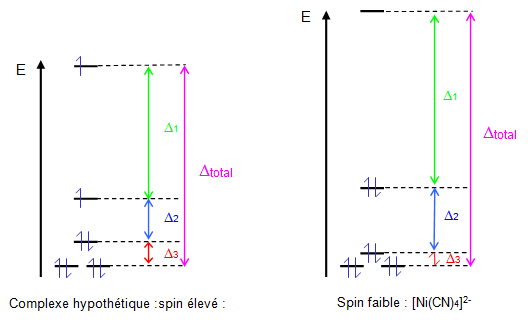
On définit ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{P}}}$ comme égal à ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{total}}}$ (${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{total}}}\text{=}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{1}}}\text{+}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{2}}}\text{+}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{3}}}$ ).
D'une manière générale ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{P}}}$ reste voisin de $\text{1}\text{,3}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{0}}}$
Fondamental :
La théorie du champ cristallin explique les propriétés magnétiques manifestées par les complexes des éléments d, en accord avec leurs géométries.
Le passage d'une configuration spin élevé à spin faible est relié à la force du champ des ligands qui doit passer de champ faible à champ fort.
Théorie du champ cristallin : explication de la couleur
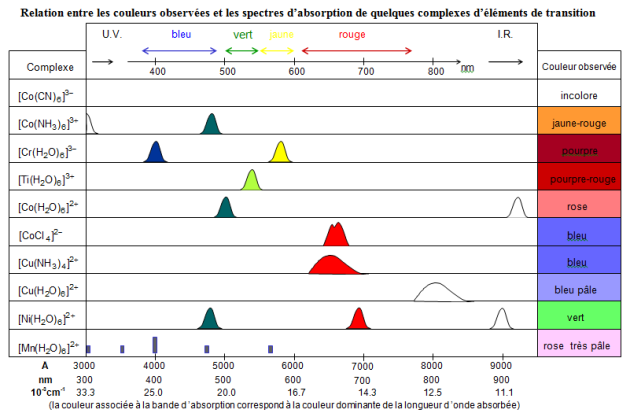
On explique la couleurs des complexes des éléments de transition par une transition électronique de type d-d au cours de laquelle un électron passe du niveau ${{\text{t}}_{\text{2g}}}$ au niveau ${{e}_{\text{g}}}$ pour une géométrie octaédrique. Ces transitions résultent de l'absorption d'un photon de la lumière visible et la couleur observée correspond à la couleur complémentaire de la lumière absorbée.
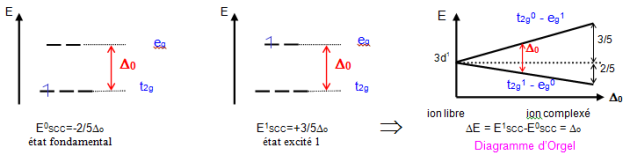
Cas de $\text{Ti}{{\left( {{\text{H}}_{\text{2}}}\text{O} \right)}_{\text{6}}}^{\text{3+}}$ composé paramagnétique de couleur violette
$\text{T}{{\text{i}}^{\text{3+}}}$ est un ion ${{\text{d}}^{\text{1}}}$ : l'absorption d'un photon permet la promotion du seul électron du niveau ${{t}_{2g}}$ vers le niveau ${{e}_{g}}$, donc d'un état fondamental du complexe (énergie ${{\text{E}}^{\text{0}}}$ ) à un niveau excité (énergie ${{\text{E}}^{\text{1}}}$ ) comme en témoignent les schémas ci-dessous qui permettent de construire le diagramme d'Orgel.
La transition d-d consiste au passage d'un électron du niveau $\text{t}_{\text{2g}}^{\text{1}}\text{-e}_{\text{g}}^{\text{0}}$ au niveau $\text{t}_{\text{2g}}^{\text{0}}\text{-e}_{\text{g}}^{\text{1}}$ et nécessite une énergie ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{0}}}$ . Une seule bande d'absorption est alors attendue.
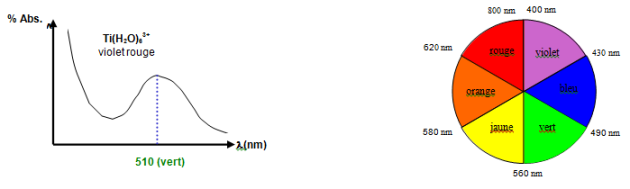
Effectivement, le spectre d'absorption de l'ion $\text{Ti}{{\left( {{\text{H}}_{\text{2}}}\text{O} \right)}_{\text{6}}}^{\text{3+}}$ ne présente qu'une bande autour de 510nm (région verte du spectre visible); il apparaît donc, à notre œil, comme présentant la couleur complémentaire (spectre blanc - bande verte = violet rouge).
Calcul de ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{0}}}$ :
$\Delta E={{\Delta }_{0}}=\frac{hc}{\text{ }\lambda \text{ }}=hc\bar{\nu }$où $\bar{\nu }=\frac{1}{\text{ }\lambda \text{ }}$ (nombre d'onde en $\text{c}{{\text{m}}^{\text{-1}}}$) dans $\text{ }S.I~\text{ }\left( en\text{ }kJ/mol \right)$ :
$\Delta E={{\Delta }_{o}}=\frac{hc}{\text{ }\lambda \text{ }}=\frac{6.62\text{ }\times \text{ }{{10}^{-34}}\text{ }\times \text{ }3\text{ }\times \text{ }{{10}^{8}}}{\text{ }\lambda \text{ }}J.m$ d'où $N\text{ }{{\Delta }_{o}}=\frac{{{1.196.10}^{5}}}{\text{ }\lambda \text{ }(nm)}=234\text{ }kJ.mo{{l}^{-1}}$
En unité $c{{m}^{-1}}$ :
$\Delta E=\text{ }{{\Delta }_{o}}=\frac{1}{{{510.10}^{-7}}}=19607\text{ }c{{m}^{-1}}\approx 20000\text{ }c{{m}^{-1}}$ avec : $\text{1c}{{\text{m}}^{\text{-1}}}\text{= 11}\text{.962 1}{{\text{0}}^{\text{-3}}}\text{kJ}\text{.mo}{{\text{l}}^{\text{-1}}}$
Soit pour un ligand ${{\text{H}}_{\text{2}}}\text{O}$ : ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{0}}}\text{= 19607 / 6 = 3268 c}{{\text{m}}^{\text{-1}}}$
Lorsqu'il y aura plusieurs électrons célibataires, plusieurs transitions entre les niveaux ${{\text{t}}_{\text{2g}}}\to {{\text{e}}_{\text{g}}}$ seront possibles. On verra donc autant de bandes d'absorption sur le spectre , celle d'énergie la plus faible (${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{0}}}$ le plus petit) correspondant à la plus grande.
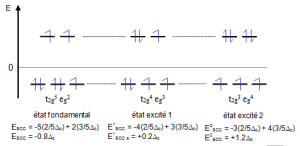
La prévision du nombre de bandes d'absorption se fait à l'aide du diagramme d'Orgel. Ce diagramme est construit après avoir déterminé les états excités possibles conduisant au même nombre d'électrons célibataires qu'à l'état fondamental ($\text{ }\!\!\Delta\!\!\text{ S=0}$ ). On obtient ainsi 3 niveaux d'énergie donc deux transitions d – d permises ce qui entraîne l'apparition de 2 bandes d'absorption sur le spectre : ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{1}}}\text{=}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{0}}}$ pour la transition $\text{t}_{\text{2g}}^{\text{5}}\text{e}_{\text{g}}^{\text{2}}\to \text{t}_{\text{2g}}^{\text{4}}\text{e}_{\text{g}}^{\text{3}}$ ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{2}}}\text{= }\text{2}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{0}}}$ pour la transition $\text{t}_{\text{2g}}^{\text{5}}\text{e}_{\text{g}}^{\text{2}}\to \text{t}_{\text{2g}}^{3}\text{e}_{\text{g}}^{\text{4}}$ |

Expérimentalement, on obtient $\text{ }{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{1}}}\text{=}\frac{\text{1}}{\text{1250}\text{.1}{{\text{0}}^{\text{-7}}}}\text{=8000 c}{{\text{m}}^{\text{-1}}}$ et $\text{ }{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{2}}}\text{=}\frac{\text{1}}{\text{520}\text{.1}{{\text{0}}^{\text{-7}}}}\text{=19230 c}{{\text{m}}^{\text{-1}}}$. La valeur de ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{0}}}$ correspond en général à l'énergie de la bande située à la longueur d'onde la plus élevée (ici ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{1}}}\text{=}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{o}}}\text{= 8000 c}{{\text{m}}^{\text{-1}}}$ ). L'énergie de la deuxième bande ne correspond pas à la valeur attendue par le diagramme d'Orgel (${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{2}}}\text{= 19230 c}{{\text{m}}^{\text{-1}}}$ au lieu de $\text{2}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{o}}}\text{= 16000 c}{{\text{m}}^{\text{-1}}}$ ). .
On pourra remarquer que la bande à la longueur d'onde la plus élevée ($\text{ }\!\!\lambda\!\!\text{ = 1250 nm}$) se trouve dans l'infrarouge et ne peut donc pas être observée sur la plupart des spectromètres classiques.
Interprétation des valeurs de $\text{ }\!\!\Delta\!\!\text{ (}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{o}}}\text{ , }{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{t}}}\text{ ou }{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{P}}}\text{)}$
Pour un complexe octaédrique, ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{o}}}$ correspond au champ cristallin exercé par 6 ligands. On peut en déduire la valeur de $\text{ }\!\!\Delta\!\!\text{ }$ associée à un ligand X : ${{\text{ }\!\!\Delta\!\!\text{ }}_{\text{X}}}\text{=}{{\text{ }\!\!\Delta\!\!\text{ }}_{\text{o}}}\text{/6}$.
La force du ligand détermine la couleur du complexe :
Un ligand à champ fort absorbera un photon de $\text{ }\!\!\lambda\!\!\text{ }$ petite (couleur jaune / orange)
Un ligand à champ faible absorbera un photon de $\text{ }\!\!\lambda\!\!\text{ }$ grande (couleur vert / bleu)
Couleur de quelques complexes | ||||
|---|---|---|---|---|
Complexe | Couleur du complexe | Couleur absorbée | ${{\lambda }_{abs}}\text{ }\left( nm \right)$ | ${{\Delta }_{o}}\text{ (c}{{\text{m}}^{-1}})$ |
${{\left[Co{{\left( N{{H}_{3}} \right)}_{6}} \right]}^{3+}}$ | Jaune | Violet | 380 | 26316 |
${{\left[Co{{\left( N{{H}_{3}} \right)}_{5}}NCS \right]}^{2+}}$ | Orange | Bleu | 470 | 21277 |
${{\left[Co{{\left( N{{H}_{3}} \right)}_{5}}{{H}_{2}}O \right]}^{2+}}$ | Rouge | Bleu-vert | 500 | 20000 |
$\begin{array}{*{35}{l}}{{\left[Co{{\left( N{{H}_{3}} \right)}_{5}}Cl \right]}^{2+}} \\\end{array}$ | Pourpre | Jaune-vert | 530 | 18868 |
$Trans{{\left[Co{{\left( N{{H}_{3}} \right)}_{4}}C{{l}_{2}} \right]}^{+}}$ | Vert | Rouge | 680 | 14706 |
Pour cette série de complexes du cobalt III, on peut établir que la force des ligands correspond au classement suivant :
$N{{H}_{3}}>\text{ }SC{{N}^{-}}>\text{ }{{H}_{2}}O\text{ }>\text{ }C{{l}^{-}}$
De façon générale, le classement général des ligand selon leur force constitue la série spectrochimique des ligands (classement par force croissante) :
${{I}^{-}}<\text{ }B{{r}^{-}}<\text{ }C{{l}^{-}}<\text{ }{{F}^{-}}<\text{ }O{{H}^{-}}<\text{ }{{C}_{2}}{{O}_{4}}^{2-}\approx {{H}_{2}}O\text{ }<\text{ }EDTA\text{ }<\text{ }N{{H}_{3}}<\text{ }En\text{ }<N{{O}_{2}}^{-}<<\text{ }C{{N}^{-}}<\text{ }CO$
Pour un même ligand, on constate que la force du champ cristallin dépend aussi du cation :
elle augmente avec la charge du cation
pour un degré d'oxydation donné, elle augmente avec la période (5d > 4d > 3d)
On peut donc construire également une série spectrochimique des cations :
$M{{n}^{II}}<\text{ }N{{i}^{II}}<\text{ }C{{o}^{II}}<\text{ }F{{e}^{III}}<\text{ }C{{r}^{III}}<\text{ }{{V}^{III}}<\text{ }C{{o}^{III}}<\text{ }R{{h}^{III}}<\text{ }R{{u}^{III}}<\text{ }P{{d}^{IV}}<\text{ }R{{e}^{IV}}<\text{ }P{{t}^{IV}}$
Ainsi, le passage d'une configuration spin élevé à spin faible sera facilité dans un complexe engageant un cation situé à gauche de la série précédente et un anion (ou molécule) situé à droite de la série des ligands.
Remarque : si les orbitales d sont pleines (ions $\text{ }Z{{n}^{2+}},\text{ }C{{u}^{+}},\text{ }S{{c}^{3+}}$ ), les complexes sont incolores car aucune transition d-d ne peut être observée.
En exploitant un diagramme d'Orgel pour les géométries tétraédrique et plan-carré, on peut prévoir le nombre de bandes permises. A l'inverse, l'exploitation des spectres optiques permet de déterminer les énergies de dédoublement $\text{ }\!\!\Delta\!\!\text{ }$ pour divers complexes et diverses coordinations.
Application : La figure suivante montre la relation entre la couleur d'un complexe et les bandes d'absorptions observées dans la gamme de longueurs d'onde 300-900 nm.
On peut constater que le remplacement du ligand ${{\text{H}}_{\text{2}}}\text{O}$ par le ligand $\text{N}{{\text{H}}_{\text{3}}}$ dans le complexe du cuivre II fait passer la couleur de bleu pâle ($\text{ }\!\!\lambda\!\!\text{ }\approx \text{800 nm}$) à bleu foncé ($\text{ }\!\!\lambda\!\!\text{ }\approx \text{680 nm}$) par simple augmentation de la force des ligands ($\text{N}{{\text{H}}_{\text{3}}}\text{}{{\text{H}}_{\text{2}}}\text{O}$ ). Cette modification de couleur se fait sans changement de géométrie (complexe octaédrique). La même remarque peut être faite pour les complexes octaédriques du cobalt III avec les ligands $\text{N}{{\text{H}}_{\text{3}}}$ et $\text{C}{{\text{N}}^{\text{-}}}$ .
De la même manière, on peut comprendre le changement de couleur observé lorsqu'on laisse le chlorure de cobalt anhydre au contact d'une atmosphère humide (passage du bleu au rose). Ici le changement de couleur est essentiellement lié à un changement de géométrie.
$$\begin{align}& \text{CoC}{{\text{l}}_{\text{2}}}\text{+ 6 }{{\text{H}}_{\text{2}}}\text{O }\!\!~\!\!\text{ }\to \text{CoC}{{\text{l}}_{\text{2}}}\text{,6 }{{\text{H}}_{\text{2}}}\text{O} \\& \text{bleu}\ ~~~~~~~~~~\ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \text{rose} \\\end{align}$$
$$\begin{align}& C{{o}^{2+}}{{\left[ CoC{{l}_{4}} \right]}^{2-}}+\text{ }12\text{ }{{H}_{2}}O\to 2\text{ }{{\left[ Co{{\left( {{H}_{2}}O \right)}_{6}} \right]}^{2+}}+\text{ }4\text{ }C{{l}^{-}} \\& ~~~~~~~~~\left[ 4 \right]~~~~~~~~~~~~~~~~~~~~~~~\text{ }~~~~~\text{ }~~~~~~\text{ }~~~~~~~~~\left[ 6 \right] \\\end{align}$$
L'hydratation de $\text{CoC}{{\text{l}}_{\text{2}}}$ est un phénomène naturel car, d'une part ${{\text{H}}_{\text{2}}}\text{O}$ est un ligand plus fort que $\text{C}{{\text{l}}^{\text{-}}}$ et d'autre part le cobalt II est plus stabilisé en coordinence octaédrique qu'en coordinence tétraédrique. Ce changement de ligand est associé à un changement de géométrie (tétraèdre-octaèdre) et à une modification de la couleur. La réversibilité de la réaction a donné lieu à des applications ludiques comme le baromètre (bleu = beau temps et rose = temps pluvieux) ou l'encre invisible.
Fondamental :
La couleur des complexes d'éléments d est majoritairement expliquée par des transitions d-d.