- Voie 1
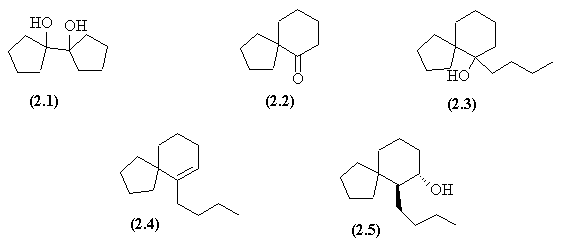
- Le couplage réductif de la cyclopentanone (passage par un anion radical) conduit au glycol (2.1).
- Ce glycol symétrique donne en milieu acide un réarrangement pinacolique conduisant à une spirocétone (2.2).
- L'AdN du lihien conduit à l'alcool (2.3) qui, transformé en chlorure subit une E.
- L'AdE du borane est une cis addition régiosélective; elle est suivie de l'oxydation de l'alkylborane. La chaine butyl et le groupe OH se trouvent donc en position trans dans le composé (2.5).
- Le composé (2.12) contient 4 stéréocentres.
- Voie 2

- Dans la seconde voie, le carbanion en Α de l'ester (stabilisé par mésomérie avec la double liaison voisine) donne une SN sur le bromobutanoate pour donner le diester (2.6).
- La réaction suivante est une réaction de Dieckmann conduisant à un cétoester qui est décarboxylé en spiro cétone (2.7).
- L'oxime de cette cétone est préparé ensuite (2.8).
- L'hydrogène du groupe OH de l'oxime est acide et une alkylation est réalisée ( SN) pour conduire à (2.9). Cette réaction est tout à fait identique à la protection d'une fonction alcool par une fonction éther benzilique.
- Une addition électrophile sur la double liaison conduit à (2.10). Le brome entre par la face opposée au groupe N-O-CH2-C6H5
- L'oxydation de la fonction alcool donne (2.11).