Rappels
L'équation d'état
d'un gaz parfait est P.V = nRT
n est la quantité du gaz considéré en môle, P la pression du gaz, V son volume et T sa température en degré Kelvin.
R est la constante des gaz parfaits. En unités SI, on a R = 8,3144... J.mol−1.K−1.
Si l'on exprime les pressions en Bar et les volumes en Litre on obtient R = 8,3144.10−2 L.Bar.mol−1.K−1.
Pour un gaz parfait monoatomique on a Cv =3 R / 2, Cp = 5 R / 2, γ = 5 / 3
Pour un gaz parfait diatomique on a Cv =5 R / 2, Cp = 7R / 2, γ = 7 / 4 = 1,4.
On a également Cp − Cv = R, Cv = R / ( γ − 1), Cp = γ R / ( γ − 1).
Entropie d'un gaz parfait
De la première identité thermodynamique : dU = T.dS − PdV, on peut tirer les expressions suivantes de l'entropie d'un gaz parfait
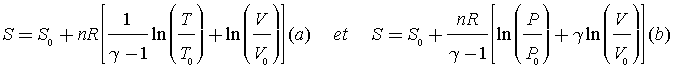
Loi de Laplace ![]()
Dans une transformation réversible : dS = δQ / T.
Dans une transformation adiabatique réversible δQ = 0, donc dS =0.
L'entropie est constante dans une transformation adiabatique réversible.
Utilisation
Données utilisées dans le programme :
On a pris nR = 4.10−3 . P0 = 1 Bar, V0 = 1,2 L ce qui donne T0 = 300 K
Les entropies sont calculées avec les valeurs P0, V0 et T0.
Pour simplifier les calculs numériques des entropies on a posé nR / (γ −1) = 1.
Pour exprimer les entropies en Joules par Kelvin, il faut multiplier les valeurs indiquées par
nR / (γ −1)
Les transformations sont représentées à la fois dans le diagramme de Clapeyron (PV) et dans le diagramme entropique (TV).
Les transformations correspondent à des évolutions réversibles : Il est possible d'utiliser la relation (b) de l'entropie pour le tracé des isobares et des isochores dans le diagramme TS. De même on peut utiliser la relation (a) pour effectuer les tracés des isothermes et des adiabatiques dans le diagramme PV.
Isobares
Pour une isobare on a V / T = V0 / T0. C'est la loi de Guy-Lussac
On fait varier le volume en maintenant la pression constante. Pour chaque valeur de V, on déduit T (PV = nRT)
A partir de la relation (b), on peut déterminer
la valeur de S. Dans le plan TS les isobares ont une allure d'exponentielle.
Pour une même température, l'entropie décroît lorsque la pression augmente.
Si on augmente le volume, la température et l'entropie augmentent.
Isochrores
Pour une isochore on a P / T = P0 / T0. C'est la loi de Charles
On fait varier la pression en maintenant le volume constante. Pour chaque valeur de P, on déduit T (PV = nRT)
A partir de la relation (b), on peut déterminer
la valeur de S.
Pour une même température, l'entropie croît lorsque la volume augmente.
Dans le plan TS les isochores ont aussi l'allure d'une exponentielle mais en un point du diagramme TS, la pente des isochores est supérieure à celle des isobares.
Isothermes
Pour une isotherme on a PV = P0.V0. C'est la loi de Mariotte
Dans le diagramme TS, T est constante : On fait varier S pour tracer en utilisant la relation (a) le diagramme PV.
Comme la température T est constante le produit PV = nRT est constant est l'isotherme dans le plan PV est une hyperbole.
On pourra vérifier que pour une isotherme donnée, le produit PV est constant et égal à nRT.
En un point A = (P, V) comme PV = Constante on a dp / p + dV / V = 0 la pente d'une isotherme sera dP / dV = − P / V.
Isentropiques ou adiabatiques réversibles
Pour une isentropique on a PVγ = Constante. C'est la loi de Laplace
Dans le diagramme TS, S est constante et on fait varier T pour tracer les diagrammes PV.
En un point A = (P, V) comme PVγ = C on a dp / p + γdV / V = 0 la pente d'une adiabatique sera dP / dV = − γP / V
Au même point A la pente de l'adiabatique est γ fois plus importante que celle de l'isotherme.
