La corrosion du fer
1. En milieu aqueux
En milieu aqueux, on trouve les espèces suivantes : $F{{e}^{0}},\text{ }F{{e}^{II}}\text{ }et\text{ }F{{e}^{III}}$
${{E}^{0}}(F{{e}^{2+}}/Fe)=-0.44\text{ }Volt$ , le fer est un réducteur
${{E}^{0}}(F{{e}^{3+}}/\text{ }F{{e}^{2+}})=\text{ }0.77\text{ }Volt$ , $\text{F}{{\text{e}}^{\text{2+}}}$ est oxydable par ${{\text{O}}_{\text{2}}}$
En milieu acide dilué : $F{{e}^{2+}}\xrightarrow{{{O}_{2}}}F{{e}^{3+}}$; par exemple avec $\text{HN}{{\text{O}}_{\text{3}}}$ dilué (mais passivation avec $\text{HN}{{\text{O}}_{\text{3}}}$ concentré).
En milieu alcalin (NaOH) :
$F{{e}^{2+}}\to $ ions ferrates (II) solubles ($\text{FeO}_{\text{2}}^{\text{2-}}\text{ : F}{{\text{e}}^{\text{+II}}}$)
$F{{e}^{3+}}\to $ ions ferrates (VI) ($\text{FeO}_{\text{4}}^{\text{2-}}\text{ : F}{{\text{e}}^{\text{+VI}}}$). Ces ions s'obtiennent en milieu oxydant, par oxydation anodique (ou par $\text{C}{{\text{l}}_{\text{2}}}$) de suspension d'oxydes ou par fusion du fer dans $\text{KN}{{\text{O}}_{\text{3}}}$ .
Ils ont un caractère oxydant (${{\text{E}}^{\text{0}}}\text{(FeO}_{\text{4}}^{\text{2-}}\text{/F}{{\text{e}}^{\text{3+}}}\text{)}\approx \text{1}\text{.9}\text{Volt}$ à pH=0).
Ils oxydent $\text{N}{{\text{H}}_{\text{3}}}\text{ en }{{\text{N}}_{\text{2}}}$, $\text{C}{{\text{r}}^{\text{3+}}}\text{ en CrO}_{\text{4}}^{\text{2-}}$.
Ils se décomposent en milieu neutre ou acide : $2FeO_{4}^{2-}\,\,+10{{H}^{+}}\,_{\to }^{\leftarrow }\,\,2F{{e}^{3+}}+{\scriptstyle{}^{3}/{}_{2}}{{O}_{2}}+5{{H}_{2}}O$.
a. Mise en évidence de la corrosion.
Les propriétés redox du milieu aqueux se déduisent du diagramme potentiel-pH dont la construction est détaillée dans le document annexe.
Données du tracé :
$${{E}_{0}}(F{{e}^{2+}}/Fe)=-0.44\,Volt\,\,;\,\,\,{{E}_{0}}(F{{e}^{3+}}/F{{e}^{2+}})=0.77\,Volt\,$$
$$p{{K}_{s}}(Fe{{(OH)}_{2}})=15.1\,\,\,\,;\,\,\,p{{K}_{s}}(Fe{{(OH)}_{3}})=\,37$$
$$p{{K}_{s}}=18.3\,\,\,pour\,\,\,\,\,Fe{{(OH)}_{2\,\,\downarrow }}\,_{\to }^{\leftarrow }\,HFeO_{2}^{-}+{{H}^{+}}$$
L'oxydation du fer suit le schéma suivant :
$$\begin{align}& \text{ }Fe\text{ }\rightleftarrows \text{ }F{{e}^{2+}}+2{{e}^{-}} \\& 2{{H}^{+}}+2{{e}^{-}}\rightleftarrows \text{ }{{H}_{2}} \\& \overline{Fe+2{{H}^{+}}\rightleftarrows \text{ }F{{e}^{2+}}+{{H}_{2}}} \\\end{align}$$
puis l'oxygène oxyde $F{{e}^{2+}}\to Fe{{\left( OH \right)}_{3}}\to F{{e}_{2}}{{O}_{3}}$ .
$$\begin{align}& \,\,\,\text{ }\,\,{\scriptstyle{}^{1}/{}_{2}}{{O}_{2}}+\,2{{H}^{+}}+2{{e}^{-}}\,\,\rightleftarrows \,{{H}_{2}}O\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\text{ }\,\,\,\,\approx 1.0\,Volt\, \\& \,\,\,\,\,\text{ }\,\,\,\,\,\,\,\,\,\,\,\,F{{e}^{2+}}+3{{H}_{2}}O\,\,\rightleftarrows \,Fe{{(OH)}_{3}}+1{{e}^{-}}+3{{H}^{+}}\,\,\,\,\approx \,0.0\,Volt \\& \overline{2F{{e}^{2+}}+{\scriptstyle{}^{1}/{}_{2}}{{O}_{2}}+5{{H}_{2}}O\,\rightleftarrows \,2Fe{{(OH)}_{3}}+4{{H}^{+}}\,\,\,\,\,\,\,}\,\,\,\,\, \\\end{align}$$
Le diagramme de POURBAIX tracé pour $\text{c=1}{{\text{0}}^{\text{-6}}}\text{M}$ donne le diagramme théorique de passivation, corrosion et immunité :
Corrosion : domaine des espèces solubles
Immunité : domaine du métal
Passivation : domaine des espèces précipitées.
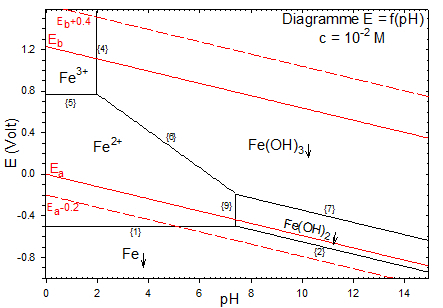
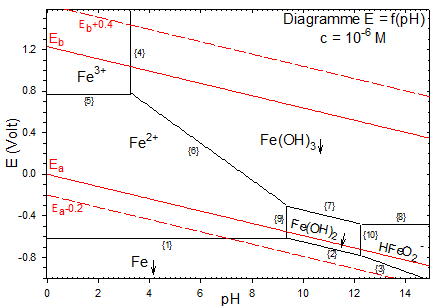
Pour passiver un métal, il faut le faire réagir avec un oxydant (oxydation anodique: protection anodique pour 8<pH<13). En fait la couche d'oxyde formée ne protège pas correctement le métal et l'attaque se poursuit (mauvaise étanchéité et mauvaise adhérence de la couche d'oxyde). Ce n'est pas une bonne méthode de protection pour le fer.
Conclusion : Le fer se corrode pour donner de la rouille à $4\le pH\le 12$.
b. Moyens de protection du métal :
Protection cathodique :
On maintient le métal dans son domaine d'immunité quel que soit le pH; pour cela, on relie le fer au pôle - d'une batterie ($\Delta E<-1.0\,Volt$) ou on utilise une électrode sacrificielle (réactive) ayant un potentiel inférieur au couple $\text{F}{{\text{e}}^{\text{2+}}}\text{/Fe}$ (par exemple en Zinc ${{\text{E}}^{\text{0}}}\text{(Z}{{\text{n}}^{\text{2+}}}\text{/Zn)=-0}\text{.76 Volt}$ ou surtout en magnésium ${{\text{E}}^{\text{0}}}\text{(M}{{\text{g}}^{\text{2+}}}\text{/Mg)=-2}\text{.48 Volt}$ ). C'est l'électrode de magnésium qui se fait alors attaquer et le fer reste intact.
Corrélat :
Galvanisation : immersion du fer dans un bain de zinc liquide (très utilisé)
Galvanoplastie : dépôt d'un métal par électrolyse puis passivation du métal par chromatation (cas du zinc et du cadmium); pour Cr et Ni il faut déposer sur du cuivre.
Protection en milieu basique (10<pH<13) : parkerisation. On dépose sur du fer une couche de phosphates par immersion des pièces dans un bain basique et chaud de phosphates ($\text{N}{{\text{a}}_{\text{3}}}\text{P}{{\text{O}}_{\text{4}}}\text{+NaOH}$). Il se forme $\text{FeP}{{\text{O}}_{\text{4}}}$ et des phosphates de Mn, Co...... Protection par revêtement externe : peintures... Cas du minium de plomb $\text{P}{{\text{b}}_{\text{3}}}{{\text{O}}_{\text{4}}}$. Il agit comme un oxydant vis à vis du fer (${{\text{E}}^{\text{0}}}\text{(P}{{\text{b}}_{\text{3}}}{{\text{O}}_{\text{4}}}\text{/PbO)= 0}\text{.5 Volt}$ à pH=8) et donne PbO+FeO ce qui forme une couche protectrice avant la première couche de peinture |  |
c. Accélération de la corrosion du métal : Par formation d'une pile électrochimique : si on relie le fer à un métal plus oxydant comme le Cuivre (${{\text{E}}^{\text{0}}}\text{(C}{{\text{u}}^{\text{2+}}}\text{/Cu)=0}\text{.34 Volt}$); le fer est sévèrement attaqué. $\to $ il faut donc proscrire les associations Fe-Cu. (cf. Annexes) |  |
2. Corrosion du fer par voie sèche
Sous l'action de la température et de l'oxygène:
A T<590°C : le fer est recouvert successivement d'une couche de $\text{F}{{\text{e}}_{\text{3}}}{{\text{O}}_{\text{4}}}$ et d'une couche externe de $\text{F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}}$
A T>590°C : le fer est recouvert successivement de couches de $\text{FeO}\text{, F}{{\text{e}}_{\text{3}}}{{\text{O}}_{\text{4}}}$ et enfin à l'extérieur de $\text{F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}}$

La réaction de dismutation : $4FeO\,_{\to }^{\leftarrow }\,F{{e}_{3}}{{O}_{4}}+Fe$ a une vitesse faible à température ambiante (FeO est alors "stable" à 25°C); FeO est non-stœchiométrique ($w\ddot{u}stite\text{ }F{{e}_{0.94}}O$ ).
On réalise des protections par formation de couches de $\text{F}{{\text{e}}_{\text{3}}}{{\text{O}}_{\text{4}}}$ (bronzage des fers et aciers) par immersion dans des mélanges de nitrates alcalins fondus (canons de fusils).




