Utilisation des potentiels standards - La prévision des réactions redox
La constante d'équilibre et les potentiels redox
Soit un équilibre redox :
$$\begin{align}& o{{x}_{1}}+re{{d}_{2}}\rightleftarrows re{{d}_{1}}+o{{x}_{2}}\ \ \ avec\ Q=\frac{\left[ re{{d}_{1}} \right]\cdot \left[ o{{x}_{2}} \right]}{\left[ o{{x}_{1}} \right]\cdot \left[ re{{d}_{2}} \right]}\ \ \ alors\ E=E_{1}^{0}-E_{2}^{0}+\frac{0.059}{n}\log \frac{\left[ o{{x}_{1}} \right]\cdot \left[ re{{d}_{2}} \right]}{\left[ re{{d}_{1}} \right]\cdot \left[ o{{x}_{2}} \right]} \\& \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ ou\ \ \ \ \ \ \ \ \ \ \ \ \ \ E=E_{1}^{0}-E_{2}^{0}-\frac{0.059}{n}\log Q \\& \grave{a}\ l'\acute{e}quilibre\ E=0\ \ \ \ \ et\ \ \ \ \ \ \ Q=K\ \ \ \ donc:\ \ \ \ \ \ \ \ \ \log \ K=(E_{1}^{0}-E_{2}^{0})\cdot \frac{n}{0.059} \\\end{align}$$
Applications :
Pile Daniell : $\ C{{u}^{2+}}+\ Zn\rightleftarrows Cu+Z{{n}^{2+}}\ $( $E_{C{{u}^{2+}}/Cu}^{0}=0.34\ Volt$ , $E_{Z{{n}^{2+}}/Zn}^{0}=-0.76\ Volt$. n=2). On obtient :
$$\begin{align}& On\ pose\ \ \ \ \ \ E=E_{C{{u}^{2+}}/Cu}^{0}-E_{Z{{n}^{2+}}/Zn}^{0}-\frac{0.059}{2}\log K\ \ \ \ \ \ \ \ \ \ \ \ E>0\ \ \ \ (une\ \ fem\ \ est\ toujours\ positive) \\& \grave{a}\ l'\acute{e}quilibre\ E=0\ donc:\ \ \ \ \ \ \ \ \ \log \ K=(E_{C{{u}^{2+}}/Cu}^{0}-E_{Z{{n}^{2+}}/Zn}^{0})\cdot \frac{2}{0.059}=(0.34+0.76)\cdot \frac{2}{0.059}=37.3 \\& \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ K=1.9\ {{10}^{37}}\ \ \ \ la\ r\acute{e}action\ sera\ totale\ dans\ le\ sens\ choisi\ (gauche\ \to droite) \\\end{align}$$
Autre exemple : $\ F{{e}^{3+}}+\ C{{e}^{3+}}\rightleftarrows F{{e}^{2+}}+C{{e}^{4+}}$($E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}=0.77\ Volt$, $E_{C{{e}^{4+}}/C{{e}^{3+}}}^{0}=1.44\ Volt$, n=1). On obtient :
$$\begin{align}& On\ \acute{e}crit\ \ \ \ \ \ E=E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}-E_{C{{e}^{4+}}/C{{e}^{3+}}}^{0}-0.059\ \log K\ \ \ \\& \grave{a}\ l'\acute{e}quilibre\ E=0\ donc:\ \ \ \ \ \ \ \ \ \log \ K=(E_{F{{e}^{3+}}/F{{e}^{2+}}}^{0}-E_{C{{e}^{4+}}/C{{e}^{3+}}}^{0})\cdot \frac{1}{0.059}=(0.77-1.44)\cdot \frac{1}{0.059}=-11.35 \\\end{align}$$
$$\begin{align}& K=4.46\ {{10}^{-12}}\ \ \ \ la\ r\acute{e}action\ sera\ totale\ dans\ le\ sens\ contraire\ au\ sens\ d'\acute{e}criture\ ,\ il\ vaut\ mieux\ \acute{e}crire\ : \\& \ \ \ \ \ \ \ \ \ \ \ \ C{{e}^{4+}}+F{{e}^{2+}}\rightleftarrows C{{e}^{3+}}+F{{e}^{3+}}\ \ \ car\ la\ r\acute{e}action\ sera\ totale\ vers\ la\ droite \\\end{align}$$
Cette réaction redox est utilisée pour pour le dosage potentiométrique du Fer II.
Utilisation de l'échelle des potentiels redox standards
Fondamental :
Tout couple redox oxyde un couple redox de potentiel inférieur
Exemple : Que se passe-t-il si on plonge une lame de cadmium métallique dans une solution de sulfate de cuivre ?
$$E_{C{{u}^{2+}}/Cu}^{0}=0.34\ Volt\ \ et\ \ \ E_{C{{d}^{2+}}/Cd}^{0}=-0.40\ Volt$$
Le couple du cuivre est oxydant vis à vis de celui du cadmium.
La réaction susceptible de se produire est donc : $\ C{{u}^{2+}}+\ Cd\to Cu+C{{d}^{2+}}\ $.
La lame de cadmium sera recouverte d'une couche de cuivre.
Dans le cas inverse où on trempe une lame de cuivre dans une solution contenant des ions $C{{d}^{2+}}$ , il ne se passe rien, le cadmium étant déjà sous sa forme oxydée.
Complément :
Simulation :
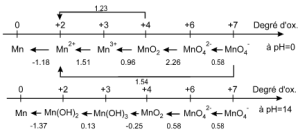
Les représentations graphiques de l'oxydo-réduction : Diagrammes de Latimer et de Frost
Exemple du manganèse
Diagramme de Latimer. On porte sur un axe de gauche à droite toutes les espèces par degré d'oxydation croissant :
On peut calculer le potentiel d'un couple à partie des valeurs déjà connues en utilisant la relation : $${{E}_{j}}=\frac{\sum\limits_{i}{{{n}_{i}}{{E}_{i}}}}{{{n}_{j}}}$$ Où ni,j représentent les électrons échangés. On a dismutation si l'espèce située à droite a un potentiel inférieur : par exemple à pH=14, $M{{n}^{+III}}$ , n'est pas stable : $2Mn{{(OH)}_{3}}\to Mn{{(OH)}_{2}}+Mn{{O}_{2}}+2{{H}_{2}}O$ |
Diagramme de Frost ou d'Ebsworth : On trace $\Delta G*~=~f\left( Degre~d'oxydation \right)$ , avec : $$\Delta {{G}^{*}}={}^{\Delta {{G}^{0}}}/{}_{F}=-n{{E}^{0}}$$
On peut constater que $MnO_{4}^{2-}$ est stabilisé en milieu basique, mais une acidification par un acide faible ($C{{O}_{2}}\text{ }air$ ) provoque sa dismutation suivant la réaction : $$3MnO_{4}^{2-}+4{{H}^{+}}\to Mn{{O}_{2}}+2MnO_{4}^{-}+2{{H}_{2}}O$$ | 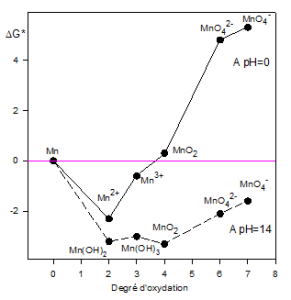 |