Configuration électronique des éléments
3.1. Les orbitales atomiques
Les électrons d'un atome n'ont pas tous la même énergie.
Au début du 20ème siècle, la mécanique quantique a montré que chaque électron est localisé dans un volume de l'espace, que l'on appelle une orbitale atomique, dans leque la probabilité de trouver l'électron est au moins de 99% (valeur arbitraire).
Les orbitales atomiques sont caractérisées par 3 nombres quantiques n, $\ell $ et m (nombre entiers) qui définissent l'énergie de l'électron dans l'orbitale.
L'électron n'est pas localisé au sens ponctuel du terme mais on peut décrire des régions de l'espace où cet électron a une forte probabilité de se trouver : c'est l'orbitale atomique.
Les figures suivantes montrent des coupes du nuage électronique (diagramme de densité électronique) où, plus les points sont denses, plus la probabilité de trouver cet électron est forte. | 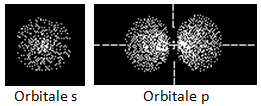 |
L'orbitale s est sphérique (l = 0),
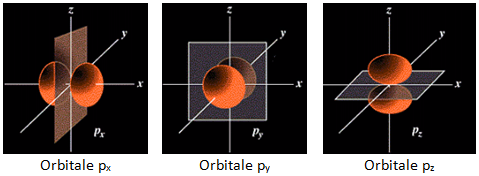
L'orbitale p (l = 1) est formée de 2 lobes centrés sur un axe commun. Il y a 3 orbitales p (m = -1, 0, +1), px suivant l'axe des x, py suivant l'axe des y et pz suivant l'axe des z,
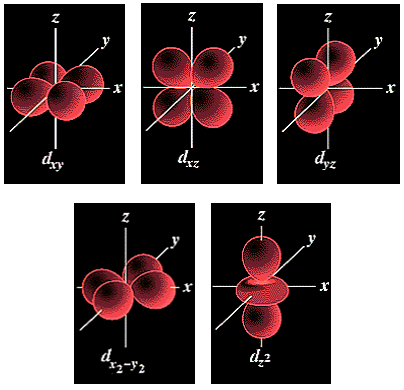
La forme des orbitales d (l = 2) est plus compliquée et il y a 5 orbitales d (m = -2, -1, 0, 1, 2):
Trois orbitales d comportent 4 lobes qui se développent dans les plans bissecteurs des quadrants : (dxy, dxz, dyz).
Les deux autres orbitales d sont centrées sur les axes :
dx2-y2 suivant les axes x et y,
dz2 a 2 lobes centrés sur l'axe z et possède un petit volume torique dans le plan xOy.
Complément : A lire avant de faire la simulation suivante
Simulation :
3.2. Les nombres quantiques
n nombre quantique principal n>0 : il définit l'énergie moyenne de l'électron situé dans la “couche” (K, L, M..).
$\ell $ nombre quantique secondaire (azimuthal) $0\le \text{ }\ell \text{ }\le \text{n-1}$ : il caractérise la forme des orbitales atomiques
Forme des orbitales $\ell $
Orbitale
Forme
0
s
sphérique
1
p
haltère
2
d
haltères croisés
3
f
multilobes complexes
m nombre quantique magnétique $-\ell \le \text{ }m\text{ }\le +\ell $ : il caractérise les différentes possibilités d'orientation spatiale des orbitales (voir figures ci-dessus).
il y a ( $\text{2}\ell \text{+1}$) orbitales
s nombre quantique de spin $s\text{ }=\pm 1/2$ : il caractérise les 2 états de rotation possibles de l'électron sur lui-même.
Principe d'exclusion de PAULI : Deux électrons d'un même atome ne peuvent avoir les 4 mêmes nombres quantiques.
Remarque :
En conséquence du Principe de Pauli, une orbitale atomique contient au plus 2 électrons.
3.3. Règles de remplissage
Les règles de remplissage des niveaux électroniques sont les suivantes :
Chaque atome possède alors une “structure ou configuration électronique” complète (ou réduite) qui rend compte des niveaux d'énergie occupés par ses électrons: $\mathbf{S}~~~~~1{{s}^{2}},\text{ }2{{s}^{2}}2{{p}^{6}},\text{ }3{{s}^{2}}3{{p}^{4}}~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~~\text{ }\left[ Ne \right]\text{ }3{{s}^{2}}3{{p}^{4}}$ $\mathbf{Ni}~~~1{{s}^{2}},\text{ }2{{s}^{2}}2{{p}^{6}},\text{ }3{{s}^{2}}3{{p}^{6}},\text{ }4{{s}^{2}}3{{d}^{8}}~~~~~~~~~~~~~~~~~~~~~~~~~~~\text{ }\left[ Ar \right]\text{ }4{{s}^{2}}3{{d}^{8}}$ $\mathbf{Zr}~~~~1{{s}^{2}},\text{ }2{{s}^{2}}2{{p}^{6}},\text{ }3{{s}^{2}}3{{p}^{6}},\text{ }4{{s}^{2}}3{{d}^{10}}4{{p}^{6}},\text{ }4{{d}^{2}}5{{s}^{2}}~~~~\text{ }\left[ Kr \right]\text{ }4{{d}^{2}}5{{s}^{2}}$ |  |
Remarques:
à partir de Z=20, le niveau 4s est inférieur au niveau 3d...
Les structures électroniques correspondant à des orbitales p ou d demi-pleines sont assez stables (les exceptions rencontrées comme Cu, Cr.. caractérisent cette stabilité) et celles correspondant à des niveaux saturés (gaz rares) sont particulièrement stables.
3.4. Charge nucléaire effective
Dans un atome polyélectronique, l'attraction du noyau sur un électron est diminuée du fait de la répulsion entre électron : on dit que les électrons internes (plus proche du noyau que l'électron considéré) font écran sur l'électron externe. On définit alors pour chaque électron une charge nucléaire effective Z*<Z.
Les électrons 2s et 2p subissent l'écrantage des électrons 1s. L'écrantage pour un électron sur l'orbitale 2p est plus fort que celui d'un électron sur une orbitale 2s du fait de la forme des orbitales. | 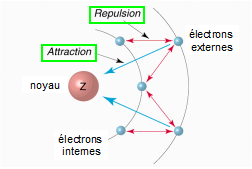 | ||||||




