Stabilité électronique
1. Energie d'ionisation ou potentiel de 1ère ionisation (IE)
C'est l'énergie nécessaire pour extraire, à l'atome gazeux isolé, l'électron le plus externe (c'est le potentiel qu'il faut appliquer à une charge e pour l'envoyer à l'infini :
$M(g)\to {{M}^{+}}+{{e}^{-}}$ (énergie en eV ; $1~eV/atome\text{ }=23,06\text{ }kcal/mole=9,649\text{ }{{10}^{4}}~J/mole$ ).
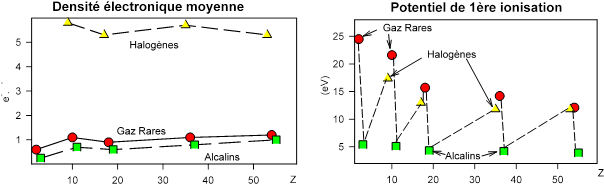
Le potentiel d'ionisation varie avec Z (voir figure)
il augmente dans une période , des alcalins aux gaz rares.
il diminue quand n augmente dans une famille
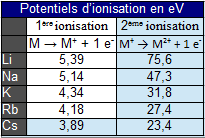
La valeur très élevée du potentiel de 2ème ionisation des alcalins s'explique par la configuration électronique de ${{\text{M}}^{\text{+}}}$ identique à celle des gaz rares.
2. Affinité électronique (AE)
Soit E, l'énergie nécessaire pour capter un électron :
$M(g)\,+\,{{e}^{-}}\to {{M}^{-}}$ : l'affinité électronique vaut AE =-E

L'examen des valeurs de potentiel de 1ère ionisation des alcalins et de l'affinité électronique pour les halogènes met en évidence la très grande stabilité de la structure électronique des gaz rares. La valeur plus faible de F s'explique par le petit rayon atomique et donc sa forte densité électronique.
Fondamental :
La configuration électronique $\text{n}{{\text{s}}^{\text{2}}}\text{n}{{\text{p}}^{\text{6}}}$ sera considérée comme une référence de stabilité
les éléments chimiques auront tendance à un comportement chimique qui les conduit à cette configuration (règle de l'octet - surtout valable dans la 2ème période où les orbitales d ne peuvent pas participer).
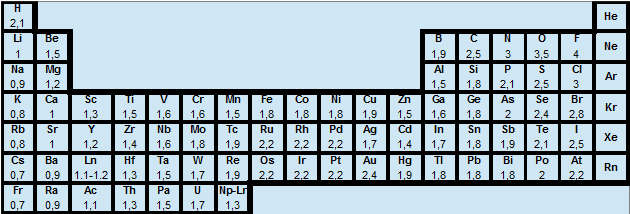
3 Electronégativité $\chi $
C'est la tendance qu'a un élément à attirer le doublet de liaison vers lui dans sa liaison covalente avec un autre élément. Dans une molécule de type AB, liée par covalence, si A est plus électronégatif que B, le doublet de liaison sera “ tiré ” vers A.
Un élément ayant une faible électronégativité aura tendance à former un cation : c'est le cas des métaux.
Un élément ayant une forte électronégativité aura tendance à former un anion : c'est le cas des non-métaux
Parmi les échelles de classement proposées, une des plus simples est l'échelle de MULLIKEN :
$$\chi \propto \frac{IE+AE}{2}$$
et des plus connues est l'échelle de PAULING, fondée sur les différences entre énergies de liaison dans la liaison hétéronucléaire et les liaisons homonucléaires
$$\left| {{\chi }_{A}}-{{\chi }_{B}} \right|=0,102\,\left[ {{E}_{AB}}-{{({{E}_{AA}}{{E}_{BB}})}^{1/2}} \right]$$
Cette notion permet de prévoir le caractère de la liaison chimique que 2 éléments peuvent contracter :
Si les électronégativités sont voisines, la liaison sera covalente,
Si les électronégativités sont très différentes, la liaison prend un caractère ionique.
L'électronégativité est une grandeur relative qui varie dans le même sens que l'affinité électronique (grandeur absolue) et l'énergie d'ionisation:
le Fluor est l'élément le plus oxydant, il a la plus grande électronégativité.
Tout élément oxyde un élément d'électronégativité inférieure.
L'électronégativité décroît :
dans une famille (colonne) quand Z augmente,
dans une période (ligne), quand Z diminue.
Parenté diagonale : la ressemblance des propriétés chimiques d'éléments situés sur une même diagonale ( surtout dans la partie gauche du tableau) s'explique par une valeur d'électronégativité voisine : par exemple, Li et Mg brûlent à l'air.
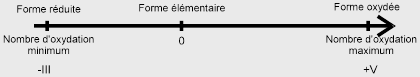
4. Nombre d'oxydation
La notion de nombre d'oxydation permet de définir un élément chimique vis à vis des autres en terme de type de réaction (oxydation ou réduction) ou en terme de comportement (oxydant ou réducteur).
$Oxydant\text{ }+n{{e}^{-}}\to r\acute{e}ducteur$ (réaction d'oxydation de gauche à droite, de réduction en sens inverse)
Sachant que dans une molécule ou dans un ion, la somme des nombres d'oxydation est égale à la charge électrique, les règles applicables sont simples :
Dans son état élémentaire, le nombre d'oxydation d'un élément est égal à 0 (zéro).
Le fluor ne peut avoir que les nombres d'oxydation (0) ou (-I) car c'est le plus oxydant des éléments.
Les métaux ont des nombres d'oxydation nuls (à l'état élémentaire) ou positifs.
Alcalins oxydés toujours +I
Alcalino-terreux oxydés toujours +II
Aluminium oxydé toujours +III
Pour les non-métaux :
le nombre d'oxydation maximum est égal au nombre d'électrons périphériques (nombre maximum de liaisons covalentes simples - à 1 doublet- susceptibles d'être contractées par l'élément)
le nombre d'oxydation minimum est égal au nombre d'électrons que l'élément doit trouver pour acquérir la structure électronique du gaz rare situé à sa droite dans la même période.
L'hydrogène adopte le plus souvent le nombre d'oxydation +I (sauf dans les hydrures comme $\text{LiAl}{{\text{H}}_{\text{4}}}$ ou $\text{Ca}{{\text{H}}_{\text{2}}}$ où il est au degré -I et associé à des métaux très électropositif). L'oxygène adopte le plus souvent le nombre d'oxydation -II (sauf dans les peroxydes comme ${{\text{H}}_{\text{2}}}{{\text{O}}_{\text{2}}}$ ou $\text{Ba}{{\text{O}}_{\text{2}}}$ où il est au degré -I, ion $\text{O}_{\text{2}}^{\text{2-}}$ ).
En exemple, la variation du nombre d'oxydation du phosphore (P, Groupe 5) est représentée suivant un axe: