Les particules élémentaires
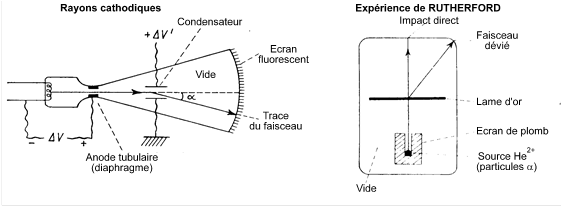
L'atome est vu comme formé par un “ nuage d'électrons chargé négativement ” (les électrons sont connus depuis la fin du 19ème siècle, rayons cathodiques) entourant un noyau chargé positivement (mis en évidence par RUTHERFORD: particules α - noyaux $\text{H}{{\text{e}}^{\text{2+}}}$ - traversant une mince lame d'or).
Les électrons forment un nuage électronique (il y a Z électrons) :
masse ${{\text{m}}_{\text{0}}}\text{ }\!\!~\!\!\text{ =9}\text{.1 1}{{\text{0}}^{\text{-31}}}\text{ }\!\!~\!\!\text{ kg}$
charge électrique $\text{q }\!\!~\!\!\text{ = }\!\!~\!\!\text{ -e }\!\!~\!\!\text{ =1}\text{.602 1}{{\text{0}}^{\text{-19}}}\text{C}$ charge électrique négative élémentaire
rayon de l'électron: $\text{r }\!\!~\!\!\text{ }\approx \text{ }\!\!~\!\!\text{ 2-3 1}{{\text{0}}^{\text{-15}}}\text{m}$
Le Noyau (contenant Z protons et N neutrons)
proton masse $\text{m }\!\!~\!\!\text{ =1}\text{.66 1}{{\text{0}}^{\text{-27}}}\text{kg }\!\!~\!\!\text{ }\left( \text{1840 }{{\text{m}}_{\text{0}}} \right)$
charge électrique $\text{q }\!\!~\!\!\text{ = }\!\!~\!\!\text{ +e }\!\!~\!\!\text{ =1}\text{.602 1}{{\text{0}}^{\text{-19}}}\text{C }\!\!~\!\!\text{ }$ (opposée à celle de l'électron)
rayon du proton : $\text{r }\!\!~\!\!\text{ }\approx \text{1}{{\text{0}}^{\text{-15}}}\text{m}$
neutron (découvert par CHADWICK en 1932, durée de vie brève 20mn)
masse ≈ proton charge électrique nulle q = 0
Le volume occupé réellement par les particules (noyau+électrons) est d'environ $\text{1}{{\text{0}}^{\text{-15}}}$ du volume effectif de l'atome; le volume réel est essentiellement celui occupé par le nuage électronique.
Un élément chimique est caractérisé le nombre de proton dans le noyau : c'est le numéro atomique Z. Le nombre de nucléons (protons + neutrons) définit le nombre de masse A. Un élément peut avoir plusieurs isotopes (le nombre de neutrons N est différent) noté ${}_{Z}^{A}X$ : les isotopes peuvent être stables ou instables ( radioactifs).
ex : $_{\text{6}}^{\text{12}}\text{C}$ stable (98,89%) $_{\text{6}}^{\text{13}}\text{C}$ stable (1,11%) $_{\text{6}}^{\text{14}}\text{C}$ instable (traces)




