La stéréochimie des molécules covalentes
Fondamental : Méthode V.S.E.P.R.
Valence Shell Electronic Pairs Repulsion
“ La forme des édifices covalents (molécules ou ions) est déterminée par la répulsion des volumes électroniques formés par les doublets électroniques (Paires électroniques) situés dans la couche de valence (couche périphérique) de l'atome central (atome coordinateur)”.
Les doublets électroniques proviennent des électrons de valence de l'atome coordinateur et des électrons fournis à la liaison covalente par les atomes liés (ligands). La liaison covalente est considérée comme un volume électronique :
L'atome coordinateur (A) est donc entouré par des volumes électroniques constitués par m volumes électroniques liants (X) et éventuellement n doublets électroniques non-liants (E), l'édifice formé est alors représenté par $\text{A}{{\text{X}}_{\text{m}}}{{\text{E}}_{\text{n}}}$ . L'atome coordinateur est celui qui possède l'électronégativité la plus faible. Le tableau ci-dessous résume les 5 cas essentiels (cliquez sur les liens des formules pour accéder au modèle interactif) :
$\text{S}{{\text{F}}_{\text{4}}}\text{ et PO}{{\text{F}}_{\text{3}}}$ sont traités ici comme exemples de détermination de la forme d'un édifice lié par covalence : |
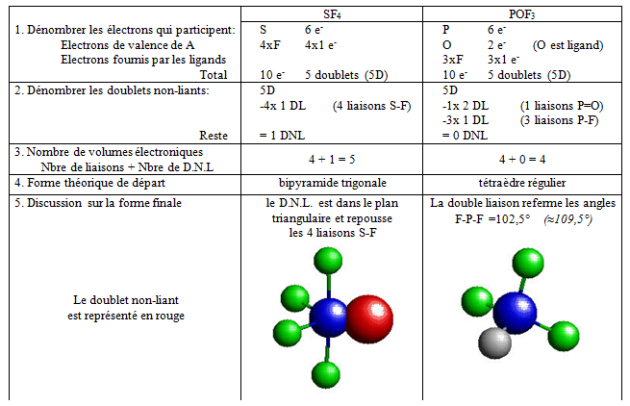
Simulation : La stéréochimie des molécules covalentes par l'exemple
Cliquez sur les liens des formules pour accéder au modèles interactifs
2 volumes électroniques | 3 volumes électroniques | 4 volumes électroniques | 5 volumes électroniques | 6 volumes électroniques |
|---|---|---|---|---|




