Le recouvrement orbital
La figure présente le cas de 2 atomes d'hydrogène ${{\text{H}}_{\text{A}}}\text{ et }{{\text{H}}_{\text{B}}}$ .
| 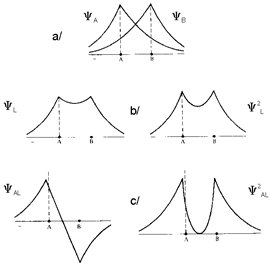 |
La liaison covalente implique l'existence d'un doublet électronique commun constitué par le recouvrement de 2 orbitales atomiques contenant chacune 1 électron (une probabilité notable de la présence simultanée des 2 électrons se trouve définie dans cet espace commun).
L'intégrale de recouvrement $S=\int{{{\Psi }_{A}}.{{\Psi }_{B}}dv}$ rend compte des conditions énergétiques du recouvrement.
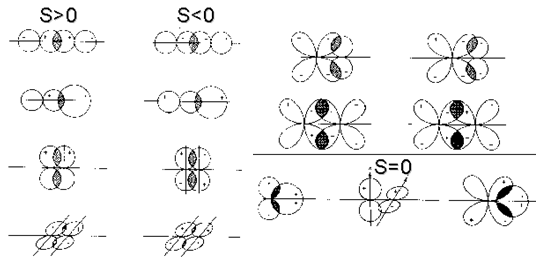
S>0 correspond à une combinaison liante du type ${{\text{ }\!\!\Psi\!\!\text{ }}_{\text{L}}}\text{=}{{\text{ }\!\!\Psi\!\!\text{ }}_{\text{A}}}\text{ }\!\!~\!\!\text{ + }\!\!~\!\!\text{ }{{\text{ }\!\!\Psi\!\!\text{ }}_{\text{B}}}$
S<0 correspond à une combinaison anti-liante du type ${{\text{ }\!\!\Psi\!\!\text{ }}_{\text{AL}}}\text{=}{{\text{ }\!\!\Psi\!\!\text{ }}_{\text{A}}}\text{ }\!\!~\!\!\text{ - }\!\!~\!\!\text{ }{{\text{ }\!\!\Psi\!\!\text{ }}_{\text{B}}}$
S=0 correspond à une combinaison non liante du type ${{\text{ }\!\!\Psi\!\!\text{ }}_{\text{NL}}}$
Le signe des fonctions d'onde atomiques est déterminant. Les différentes possibilités de recouvrement sont représentées sur la figure ci-contre.
La liaison covalente entre 2 atomes résulte du recouvrement de 2 orbitales atomiques (une pour chaque atome, contenant chacune 1 électron, il y a donc 2 états d'énergie atomiques) qui crée un doublet de liaison dont l'énergie peut prendre 2 valeurs qui correspondent aux cas liant ou anti-liant.