Les liaisons résonantes
L'ion $\text{NO}_{\text{3}}^{\text{-}}$ possède une forme triangulaire plane (obtenue par la méthode VSEPR décrite plus haut) due à la présence de 3 volumes électroniques constitués chacun de 2 D.L. (3 liaisons N=O).
Cependant, il n'est pas possible que l'azote contienne 12 e- (6 D) dans sa couche de valence (contradiction avec la règle de l'octet, introduite par LEWIS, qui caractérise la stabilité électronique des éléments de la 2ème période (C, N, O, F) quand ils adoptent la configuration Gaz Rare du Néon - 8 e- dans la couche de valence -).
Il faut donc envisager, sur la base de la forme géométrique trouvée, une répartition de l'ensemble des électrons qui satisfasse les conditions de stabilité. On décompte donc tous les électrons :
$$\text{5}{{\text{e}}^{\text{-}}}\text{(N)}\text{+}\text{3x6}{{\text{e}}^{\text{-}}}\text{(3}\text{O)}\text{+}\text{1}{{\text{e}}^{\text{-}}}\text{(charge }\text{de }\text{l'ion)=24}{{\text{e}}^{\text{-}}}\text{(12}\text{ doublets)}$$
On répartit ces doublets en partant de l'atome central (N) en lui affectant 4 D (un octet) et en complétant sur les ligands (O) tout en respectant la règle de l'octet. On obtient 3 répartitions équivalentes (d'énergie identique) qui se déduisent l'une de l'autre par une rotation de 120°: ce sont les 3 formes résonantes de l'ion $\text{NO}_{\text{3}}^{\text{-}}$. Cela signifie que la configuration électronique de cet ion oscille constamment entre ces 3 états (il résonne). Il faut noter que cette résonance ne nécessite qu'un déplacement électronique réduit. On peut alors décrire l'état de liaison par 3 liaisons $\sigma $ et une liaison $\pi $ délocalisée. | 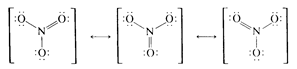 |
Remarque :
Dans le cas des éléments de la 3ème période et au delà, la possibilité de disposer de niveaux électroniques nd vides et proches en énergie, modifie la situation et permet à ces éléments d'accepter plus d'un octet dans la couche de valence (6 doublets pour X = Cl, Br, S, P).
C'est le cas dans des édifices comme $\text{S}{{\text{F}}_{\text{6}}}$ , $\text{PO}_{\text{4}}^{\text{3-}}$.....




