Le fer aux degrés +II et +III dans l'état solide
a. FeO (Wustite) C'est un oxyde lacunaire (en théorie, il ne peut exister à T<590°C), en fait on l'obtient par décomposition thermique sous vide de l'oxalate : $$Fe{{C}_{2}}{{O}_{4}}\xrightarrow{\Delta }\,FeO+CO+C{{O}_{2}}$$ FeO est non stœchiométrique. Le cristal parfait aurait une structure NaCl (a=4.32 Å), en fait c'est $\text{F}{{\text{e}}_{\text{0}\text{.94}}}\text{O}$ avec a=4.28 Å. Il y a un déficit de 6% en $\text{F}{{\text{e}}^{\text{2+}}}$ (6% de lacunes $\square $ ). Ce sont des défauts de Schottky (par opposition aux défauts de Frenkel : lacunes $\square $ + intersticiels. | 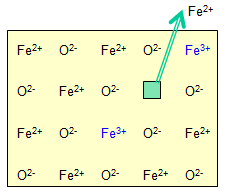 |
$$\begin{align}& \text{ }2xF{{e}^{2+}}\to 2xF{{e}^{3+}}+2x{{e}^{-}} \\& xF{{e}^{2+}}+2x{{e}^{-}}\to x\text{ }\square \\& \overline{\text{ }2xF{{e}^{2+}}\to 2xF{{e}^{3+}}+x\text{ }\square } \\\end{align}$$
La disparition d'un ion $\text{F}{{\text{e}}^{\text{2+}}}$ s'accompagne de la formation de 2 ions $\text{F}{{\text{e}}^{\text{3+}}}$ et d'une lacune $\square $ : on a donc $F{{e}_{1-x}}{{\square }_{x}}O\text{ (}x=0.06\text{)}$ . Mais si l'on considère les espèces du fer qui participent, la vraie formule de l'oxyde lacunaire FeO est : $F{{e}^{II}}_{1-3x}F{{e}^{III}}_{2x}{{\square}_{x}}O$. On peut suivre la croissance de FeO à partir de la surface d'un cristal de $fer\text{ }\alpha $ . La présence de lacunes facilite l'oxydation par voie sèche. |  |
b. $F{{e}_{3}}{{O}_{4}}$
La magnétite (oxyde noir) est en fait un oxyde mixte de $\text{Fe}{{\text{r}}^{\text{II}}}\text{ et Fe}{{\text{r}}^{\text{III}}}$ qu'on peut écrire : $\text{''FeO}\text{, F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}}\text{''}$ .
Structure de type spinelle $\text{A}{{\text{B}}_{\text{2}}}{{\text{O}}_{\text{4}}}$ , a=8.41 Å et Z=8, réseau cfc d'ions ${{\text{O}}^{\text{2-}}}$ (32O)
32 sites [6] : B occupe la moitié des sites octaédriques
64 sites [4] : A occupe 1/8 des sites tétraédriques
On parle de :
spinelle direct si on a $\underbrace{A}_{\left[ 4 \right]}\,\underbrace{(BB)}_{\left[ 6 \right]}\,{{O}_{4}}$ comme dans ${{\text{O}}^{\text{2-}}}$
spinelle inverse si on a $\underbrace{B}_{\left[ 4 \right]}\,\underbrace{(AB)\,}_{\left[ 6 \right]}{{O}_{4}}$ comme dans $\text{NiF}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{4}}}\text{ }\!\!~\!\!\text{ ou Fe(NiFe)}{{\text{O}}_{\text{4}}}$.
$\text{F}{{\text{e}}_{\text{3}}}{{\text{O}}_{\text{4}}}$ est un spinelle inverse : $\text{F}{{\text{e}}^{\text{III}}}\text{(F}{{\text{e}}^{\text{II}}}\text{F}{{\text{e}}^{\text{III}}}\text{)}{{\text{O}}_{\text{4}}}$
Remarque : $\text{F}{{\text{e}}^{\text{2+}}}$ est plus stabilisé en champ octaédrique qu'en champ tétraédrique (alors qu'il n'y a aucune stabilisation possible pour $\text{F}{{\text{e}}^{\text{3+}}}$ quel que soit le champ, voir le chapitre sur le Champ cristallin). C'est pourquoi la structure spinelle inverse est favorisée pour $\text{F}{{\text{e}}_{\text{3}}}{{\text{O}}_{\text{4}}}$ .
Ferrimagnétique pour T<Tc=578°C, ${{\sigma }_{s}}=4{{\mu }_{B}}/mol$
Le ferrimagnétisme s'explique par un couplage anti-parallèle entre les sites [4] et [6] : c'est un ferrimagnétisme de spin. ${{\sigma }_{s}}=\left| {{\sigma }_{\left[ 6 \right]}}-{{\sigma }_{\left[ 4 \right]}} \right|=\left| {{\sigma }_{F{{e}^{3+}}}}+{{\sigma }_{F{{e}^{2+}}}}-{{\sigma }_{F{{e}^{3+}}}} \right|=\left| {{\sigma }_{F{{e}^{2+}}}} \right|=4{{\mu }_{B}}$
c. $F{{e}_{2}}{{O}_{3}}$ : il existe plusieurs variétés
$\text{ }\!\!\alpha\!\!\text{ -F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}}$ : hématite rouge (type corindon $\text{ }\!\!\alpha\!\!\text{ -A}{{\text{l}}_{\text{2}}}{{\text{O}}_{\text{3}}}$ )
C'est la variété stable (caractère acide avec les oxyde basiques $\text{MgF}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{4}}}$ mais caractère basique avec les acides $\to \text{F}{{\text{e}}^{\text{3+}}}\text{+}{{\text{H}}_{\text{2}}}\text{O}$ .
Oxyde stable jusqu'à 1500K puis réduction : $\text{3F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}}\to \text{2F}{{\text{e}}_{\text{3}}}{{\text{O}}_{\text{4}}}\text{+1/2 }{{\text{O}}_{\text{2}}}$ (voir diagramme d'Ellingham).
Composé anti-ferromagnétique imparfait (composante ferromagnétique) : ${{\text{T}}_{\text{N}}}\text{=675K}$
Structure : réseau hexagonal compact d'ions ${{\text{O}}^{\text{2-}}}$ avec 2/3 des sites [6] occupés.
Solide réactif si préparé par déshydratation de $\text{Fe(OH}{{\text{)}}_{\text{3}}}$ à basse température (dissolution dans les acides). Si préparé à haute température ou chauffé à 1000°C $\to $ solide peu réactif.
$\text{ }\!\!\gamma\!\!\text{ -F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}}$ : c'est une variété métastable. S'obtient par oxydation de la magnétite :
$$2F{{e}_{3}}{{O}_{4}}+{\scriptstyle{}^{1}/{}_{2}}{{O}_{2}}\to 3\,\,\gamma -F{{e}_{2}}{{O}_{3}}$$
Structure cubique F de type spinelle (a=8.3 Å )
$$\underbrace{Fe_{2}^{III}F{{e}^{II}}{{O}_{4}}}_{a=8.41}\to \underbrace{Fe_{2}^{III}Fe_{0.666}^{III}{{\square }_{0.333}}{{O}_{4}}}_{a=8.3}\left( \times 3 \right)\to Fe_{8}^{III}\square {{O}_{12}}\equiv F{{e}_{2}}{{O}_{3}}\equiv F{{e}_{2}}{{\square }_{0.25}}{{O}_{3}}$$
C'est donc un spinelle lacunaire
C'est un ferrimagnétique fort (${{T}_{C}}=575{}^\circ C$ , valeur expérimentale ${{\sigma }_{\exp }}=2.4{{\mu }_{B}}$)
$$\begin{align}& \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,2F{{e}^{2+}}\to 2F{{e}^{3+}}+2{{e}^{-}} \\& \,\,\,\,\,\,{\scriptstyle{}^{1}/{}_{2}}{{O}_{2}}+2{{e}^{-}}\to {{O}^{2-}} \\& \overline{\,2F{{e}^{2+}}+{\scriptstyle{}^{1}/{}_{2}}{{O}_{2}}\to 2F{{e}^{3+}}+{{O}^{2-}}} \\\end{align}$$
Les propriétés dérivent de celles du spinelle car :
$$\gamma -F{{e}_{2}}{{O}_{3}}\equiv Fe_{8}^{III}{{O}_{12}}\equiv Fe_{^{8}{{/}_{3}}}^{III}{{O}_{4}}\equiv Fe_{2.666}^{III}{{O}_{4}}\equiv \underbrace{\left[ F{{e}^{III}} \right]}_{A}\underbrace{\left[ Fe_{1.666}^{III}{{\square }_{0.333}} \right]}_{{{B}_{2}}}{{O}_{4}}$$
$${{\sigma }_{th\acute{e}orique}}=\left| {{\sigma }_{\left[ 6 \right]}}-{{\sigma }_{\left[ 4 \right]}} \right|=\left| 1.666\,{{\sigma }_{F{{e}^{3+}}}}-{{\sigma }_{F{{e}^{3+}}}} \right|=0.666\,\left| {{\sigma }_{F{{e}^{2+}}}} \right|=0.666\times 5{{\mu }_{B}}=3.33{{\mu }_{B}}$$.
La formule réelle étant $\gamma -F{{e}_{2}}{{O}_{3}}$ avec ${{\sigma }_{s}}=\tfrac{3}{4}\times 3.33{{\mu }_{B}}=2.5{{\mu }_{B}}$




